티움바이오, 키트루다 병용 임상 설계 바꾼 이유는 작년 6월 MSD와 파트너십 체결에 따른 2a상 프로토콜 변경 때문
홍숙 기자공개 2023-05-24 10:51:33
이 기사는 2023년 05월 23일 15:55 thebell 에 표출된 기사입니다.
티움바이오가 항암제 파이프라인에 대한 임상 프로토콜을 일부 변경한다. 작년 미국 MSD와 파트너십을 맺은 데 따른 결정이다. 임상 규모와 적응증 등에 대한 변화는 없다는 설명이다.◇작년 6월 MSD와 키트루다 무상공급·병용임 파트너십 체결
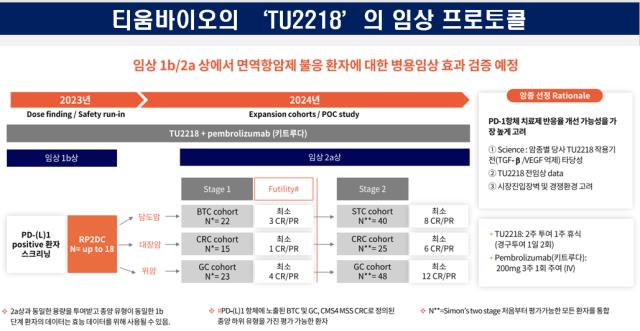
티움바이오는 2021년 식품의약품안전처와 미국 식품의약국(FDA)으로부터 TU2218 단독요법에 대한 임상 1/2 임상시험계획(IND)을 승인받았다고 밝혔다. 당시 공시된 내용에 따르면 임상 1상에서 안전성과 내약성을 측정한 이후 임상 2상에서는 용량확장에 따른 권장용량을 결정하는 것이 목표였다.
이후 티움바이오는 작년 6월 MSD와 공동연구개발 계약을 체결했다. 계약에 따라 티움바이오는 개발중인 면역항암제 TU2218과 MSD의 PD-1 면역항암제 키트루다(펨브롤리주맙)의 병용투여 임상을 진행하게 됐다.
이에 따라 티움바이오는 기존 단독투여 임상에서 키트루다 병용투여 임상으로 프로토콜을 변경하는 내용을 식약처에 제출하게 됐다. 변경된 프로토콜을 살펴보면 임상 1b상에서는 투여 후 이상반응 등을 살펴보는 안전성을 측정한다. 이후 임상 2a상에서는 완전반응(CR)과 부분반응(PR)에 대한 환자의 비율을 1차 지표로 삼는다.
김훈택 티움바이오 대표는 더벨과의 통화에서 "단독투여에서 병용투여로 변경한 것 외에는 특별한 임상 프로토콜 변화는 없다"며 "임상 규모, 암종, 임상 사이트는 동일하게 진행될 예정"이라고 말했다.
◇2026년까지 142명 대상 국내·미국 임상 차질없이 진행 예정...임상 1b상 개시
저분자화합물 기반 면역항암제로 개발하고 있는 'TU2218'과 키트루다 병용 임상 1b상이 올해 3월 첫 환자 투약이 개시됐다. 이번 임상을 통해 티움바이오는 'TU2218'과 키트루다의 병용에 대한 안전성을 확인함과 동시에 2상의 투여 적정용량을 확장한다는 계획이다. 3월 기준 첫 환자 투약은 물론 임상 1b상 전체 임상 환자 등록이 완료된 상황이다.
TU2218은 국내 및 미국에서 단독투여 임상1상(코호트5)을 진행중이며, 임상에서 안정적인 약동학(PK) 프로파일을 보이고 있다. 코호트3까지 질병통제율은 55.6%(PR-부분 관해 1명, SD-안전 병변 4명)을 기록했다.
이와 관련된 데이터는 올해 6월 미국임상종양학회(ASCO) 및 유럽종양학회(ESMO) 등 글로벌 암학회에서 공개될 예정이다. TU2218은 면역항암제의 낮은 반응률의 주요 원인으로 지목되는 TGF-β와 VEGF를 동시에 저해하는 저분자화합물 기반 면역항암제 파이프라인이다.
적응증은 고형암으로 두경부암, 담도암, 위암 등 미충족의료수요가 높은 암종을 타깃으로 한다는 전략이다. 이와 함게 섬유화 조직이 많이 분포된 암종으로 적응증을 확장해 나간다는 계획이다. 해당 임상은 2026년 12월까지 진행될 예정이며 임상 1b상에서 최대 24명, 임상 2a상에서 최대 118명을 대상으로 진행된다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- 스튜디오산타클로스ENT, 주주권익 보호 '구슬땀'
- 이에이트, AI 시뮬레이션·디지털 트윈 기술 선보여
- [2024 더벨 글로벌 투자 로드쇼-베트남]한인이 설립한 RCE, 세계 첫 ‘중장비 온라인 중고거래’
- [2024 더벨 글로벌 투자 로드쇼-베트남]베트남의 지오영 '바이메드'·전기오토바이 '셀렉스' 눈길
- 지아이에스, 코스닥 상장 위한 예비심사신청서 제출
- '910억 CB 발행' 아스트, 경영 정상화 속도 낸다
- [2024 더벨 글로벌 투자 로드쇼-베트남]"2030년까지 20개 유니콘 탄생, 지금이 투자 적기"
- [2024 더벨 글로벌 투자 로드쇼-베트남]"1억 인구, 평균연령 32세…증시 대세 상승 초입"
- [2024 더벨 글로벌 투자 로드쇼-베트남]지역별 강력한 세제 인센티브 매력 '인수합병 활발'
- '자사주 소각' 한미반도체, 주주가치 제고 재확인























