분기점 맞은 인보사 사태…"국내용·미국용 동일" [인보사 판매중단 논란]⑥한뿌리 동일세포 사용 입증돼…식약처는 추가 자체 조사 및 美 현지 실사 계획
강인효 기자공개 2019-04-16 08:24:21
[편집자주]
코오롱생명과학의 무릎 골관절염 치료제 '인보사'의 주성분이 바뀌었다는 논란이 제기되며 국내 판매와 미국 임상이 중단돼 바이오 업계에 논란이 거세지고 있다. 자칫 바이오 산업 전반에 불신을 줄 우려까지 제기된다. 인보사 논란의 주요 쟁점을 분석해본다.
이 기사는 2019년 04월 15일 15:48 thebell 에 표출된 기사입니다.
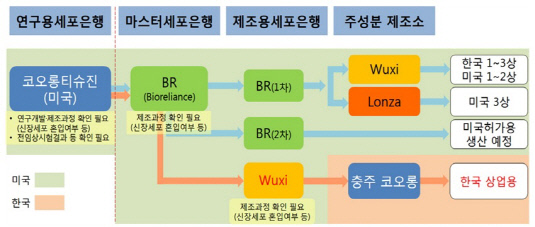
국내 최초로 허가받은 유전자 치료제 '인보사(국산 29호 신약·적응증 무릎 골관절염)'의 판매 중단 논란이 새로운 분기점을 맞았다. 인보사 주성분 변경 논란에 휩싸였던 코오롱생명과학이 국내서 판매 허가를 받은 '인보사케이(국내 제품명)'에 대해서 성분 분석을 의뢰한 결과, 주성분 중 하나인 형질전환세포(TC)가 미국 임상용 인보사와 마찬가지로 연골유래세포가 아닌 신장유래세포인 것으로 판명됐다.국내 판매용 인보사케이가 미국 임상용 인보사와 동일한 성분인 것으로 드러난 이상 코오롱생명과학은 인보사 주성분 변경 논란을 어느 정도 해소했다는 평가가 나온다. 그럼에도 불구하고 식품의약품안전처는 인보사케이에 최초 국내 허가 당시와 다른 TC가 혼입된 경위 및 이유에 대해 자체적으로 추가 조사에 나선다는 방침이다.
◇코오롱생명과학 "인보사케이 TC, 비임상부터 상업화까지 동일 세포 사용 확인"
코오롱생명과학은 15일 "단기염기서열반복(STR) 시험 검사 결과, 미국 임상용 인보사와 마찬가지로 인보사케이의 TC 역시 신장유래세포로 나타났다"며 "이로써 인보사케이의 TC가 비임상단계부터 상업화 제품에 이르기까지 동일한 세포를 사용했음이 확인됐다"고 밝혔다.
인보사는 다른 사람의 연골에서 추출한 '동종유래 연골세포(HC)'와 연골세포 성장인자인 TGF-β1 유전자를 도입한 '형질전환세포(TC)'를 3대 1의 비율로 섞어 무릎 관절강 내에 주사하는 세포유전자 치료제다.
코오롱생명과학의 미국 계열회사이자 인보사 원개발사인 코오롱티슈진이 최근 미국 임상 3상을 승인받아 진행하던 중 인보사의 주성분을 확인하기 위해 자발적으로 STR 시험 검사를 실시했는데, 검사 결과 TC가 연골세포가 아닌 신장유래세포인 'GP2-293 세포'인 것으로 밝혀진 바 있다.
미국 임상용 인보사에서 앞서 2017년 국내서 허가를 받은 인보사케이와 다른 주성분이 드러나면서 코오롱생명과학은 한국 판매용 인보사의 워킹 셀뱅크(WCB) 세포 및 제품(인보사케이)에 대한 STR 시험 검사를 미국 유전자 검사업체인 위셀에 의뢰하고 지난달 14일 인보사케이 검체를 발송했다. 동시에 해당 검사의 기준점이 되는 미국 바이오의약품 위탁생산업체(CMO) 바이오릴라이언스 내 구축된 마스터 셀뱅크(MCB)의 세포주의 TC 성분 분석도 의뢰했다.
코오롱생명과학 관계자는 "비임상단계부터 지금까지 인보사케이의 TC 성분에 GP2-293 세포가 계속 사용돼왔음을 STR 시험 결과 확인됐다"며 "이번 시험 결과를 식약처에 전달했고, 향후 자료 요청 등에도 투명하고 성실하게 임해 빠른 시일 내 환자들의 불안을 해소하도록 노력하겠다"고 말했다.
업계에선 이번 시험 결과로 코오롱생명과학이 인보사케이에 대해서 비임상단계부터 상업화 제품에 이르기까지 한 뿌리의 동일한 세포를 사용했다는 사실이 입증된 만큼 해당 제품에 대한 허가 변경을 신청하겠다는 계획이 힘을 얻게 됐다고 분석하고 있다. 즉 코오롱티슈진이 임상 3상을 진행했던 인보사와 코오롱생명과학이 국내서 판매하던 인보사케이의 TC가 동일한 MCB에서 생산된 세포주에 나온 것이라는 해석에 힘이 실리게 됐다.
업계 관계자는 "식약처 자체 조사에서도 큰 문제가 없다는 결론이 내려지면 인보사케이에 대한 의약품 허가 변경 고시 정도에서 마무리될 것으로 예상된다"며 "이는 행정 절차상으로 세포 주성분 변경 등록을 하고 다시 쓰는 것이어서 말그대로 명찰만 새로 달게 되는 것으로, 인보사케이의 정상적인 외부 시판도 가능할 것으로 전망된다"고 밝혔다.
|
식약처는 이날 보도자료를 내고 인보사케이에 대한 중간 조사 결과를 발표했다. 식약처 측은 "인보사케이의 TC가 허가 당시 제출 자료에 기재된 세포와 다른 세포로 추정된다는 코오롱생명과학 측 보고 이후, 제품 제조용 세포주 등을 수거해 STR 시험 검사를 실시한 결과, 해당 TC가 신장유래세포임을 확인했다"며 "이는 코오롱생명과학이 자체적으로 검사한 결과와 동일하다"고 설명했다.
식약처는 허가 당시 코오롱생명과학이 제출한 자료에서는 인보사케의 TC가 연골유래세포로 판단되나 국내 판매용 인보사케이의 TC가 신장유래세포로 바뀐 경위 및 이유 등에 대해 추가로 조사를 실시할 계획이라고 밝혔다.
식약처 측은 "코오롱생명과학에 인보사케이의 TC가 연골유래세포에서 신장유래세포로 바뀐 경위와 그 과정을 입증하는 과학적 근거 등 일체의 자료를 회사 측에 제출하도록 해 이를 검토할 예정"이라며 "인보사 원개발사인 코오롱티슈진 등에 대한 미국 현지 실사를 통해 해당 TC가 최초 개발단계부터 신장유래세포였는지 여부 등을 확인할 계획"이라고 덧붙였다.
식약처의 미국 현지 실사는 인보사의 MCB가 구축된 바이오릴라이언스와 이 업체가 구축한 WCB 2곳을 대상으로 이뤄질 전망이다. 아울러 국내 판매용 인보사케이의 WCB인 중국 CMO 우시엠텍도 현지 실사에 나선다는 방침이다.
식약처 관계자는 "이번에 실시한 STR 시험에 이어 '인보사의 TC가 원래부터 신장유래세포였다'는 코오롱생명과학 측 주장의 사실 여부를 확인하기 위한 시험과 안전성 문제를 확인하기 위한 시험도 진행하고 있다"며 "코오롱생명과학이 제출한 자료와 식약처 자체 시험 결과 및 미국 현지 실사 결과 등을 종합적으로 판단해 사실관계를 명확하게 확인한 뒤 그에 상응하는 행정처분 등 필요한 조치를 취하겠다"고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 이에이트, AI 시뮬레이션·디지털 트윈 기술 선보여
- MBK, '몸값 2조' 지오영 인수 SPA 체결 임박
- [2024 더벨 글로벌 투자 로드쇼-베트남]한인이 설립한 RCE, 세계 첫 ‘중장비 온라인 중고거래’
- 회계법인 해솔, 부동산 타당성 자문 업무협약
- [2024 더벨 글로벌 투자 로드쇼-베트남]베트남의 지오영 '바이메드'·전기오토바이 '셀렉스' 눈길
- 지아이에스, 코스닥 상장 위한 예비심사신청서 제출
- [꿈틀대는 토큰증권 시장]'업계 표준' 루센트블록, '두자릿수' 레코드 조준
- [Company & IB]조달 '막바지' 롯데그룹, 롯데케미칼에 쏠리는 눈
- '910억 CB 발행' 아스트, 경영 정상화 속도 낸다
- [2024 더벨 글로벌 투자 로드쇼-베트남]"2030년까지 20개 유니콘 탄생, 지금이 투자 적기"