[클리니컬 리포트]헬릭스미스의 20년 자산 '엔젠시스', 미국 임상 좌초DPN 3-3상 확장 가능성 희박, 족부궤양 3상도 미국은 조기 종료 남은 건 '중국'뿐
최은수 기자공개 2024-01-05 11:40:39
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2024년 01월 04일 08:34 thebell 에 표출된 기사입니다.
헬릭스미스가 주력 파이프라인 엔젠시스(VM202)의 당뇨병성신경병증(DPN) 임상 3상의 3-2상과 3-2b상 모두 위약군 대비 유효성 확보에 실패했다. 2020년 시작해 268명을 대상으로 도출한 톱라인 결과는 결국 엔젠시스의 당뇨병 합병증 관련 미국 임상의 종료를 의미한다. DPN 3상 프로토콜에 따라 남아있는 3-3상을 추진한 가능성도 현재로선 희박해 보인다.◇일평균 통증수치 유효성 미입증, 아직 남은 DPN 3-3상 자동 폐기 가능성↑
헬릭스미스는 3일 미국에서 진행한 VM202 DPN 임상 3상 톱라인 분석 결과 1차 평가지표를 달성하지 못했다고 밝혔다. 주평가지표인 일평균 통증수치(ADPS)에서 엔젠시스 투약군이 위약군 대비 유효성을 입증하지 못했다.
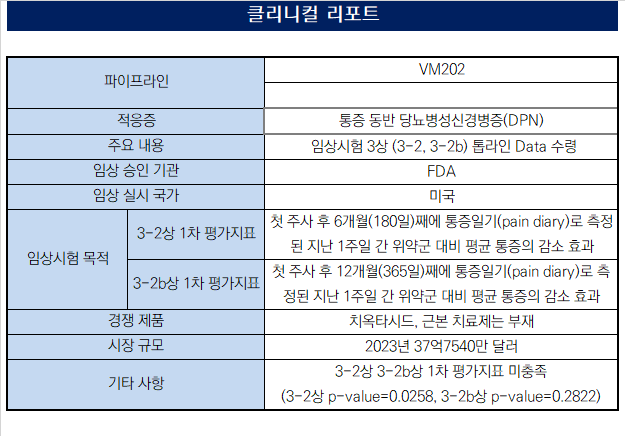
ADPS는 첫 VM202 주사 후 6개월 째 통증일기를 통해 측정했다. 헬릭스미스는 이번 3-2상에서 전자 통증일지를 사용했다. 더불어 프리가발린 혹은 가바펜틴과 같은 약물을 사용하지 않는 환자들에게서 특히 효과가 좋았던 3-1b상의 데이터에 착안해 여러 설계상의 요소들을 새로 도입했지만 유효성 문턱을 넘지 못했다.
그간 헬릭스미스가 입증하려는 통증은 주관적 영역이다보니 임상 프로토콜을 고도화해도 객관적 측정이 쉽지 않다는 지적이 있었다. 특히 3-2상에 앞서 시행된 '이중맹검' 위약군 대조 임상시험과는 상이한 결과가 나온 점도 아쉬운 대목이다. 지난 임상 2상과 임상 3-1b에서는 위약군 대비 엔젠시스군의 효과가 컸다.
상업화 길목에 한층 가까워진 후기 임상(3-2, 3-2b)에서 모두 1차 평가지표를 충족하지 못한만큼 남은 3-3상을 진행할 가능성은 희박해보인다. 헬릭스미스 내부 전략에 따라 3-3상까지 밀어붙일 여지가 없진 않다.
다만 창업주이자 전 최대주주 김선영 헬릭스미스 CTO는 2022년 DPN 중간분석 현황을 설명하는 미디어데이 등을 통해 "3-2상에서 효능이 나오지 않으면 임상을 중단하겠다"는 입장을 내놓은 바 있다.
◇DFU 남았지만 미국선 녹록지 않았던 환자 모집… 중국 임상에 사활 걸 듯
이처럼 VM202의 DPN 임상이 자동 폐기 수순에 들어설 경우 당뇨병성 합병증을 타깃하는 임상프로그램은 당뇨병성 족부궤양(Diabetic Foot Ulcer, DFU)만이 남게 된다. 헬릭스미스가 공개한 VM202의 타깃 적응증은 앞서 DPN과 DFU외에 루게릭병으로 잘 알려진 근위축성측상경화증(ALS), 관상동맥질환(CAD), 샤르코마리트수병(CMT) 등이다.
DFU의 경우 기존 설계인 환자 300명의 약 15%를 모집하는 데 그쳤지만 이 안에서 유의미한 데이터를 얻은 것은 그나마 긍정적이다. 세부적으로 엔젠시스를 주사 대상자 가운데 신경허혈성 궤양을 앓는 환자들은 주사 후 3~5개월 사이 위약군 대비 통계적으로 의미 있는 완치율(72.7%)을 관찰했다.
그럼에도 DFU 3상은 환자 모집에 난항을 겪다가 잠정 종료한 상태다. 미충족 의료수요(Unmet Medical Need)가 크지만 미국 내에선 임상수탁기관 부재나 환자 상황 등이 겹쳐 참여할 수 있는 환자가 제한된 영향이다.
헬릭스미스가 당초 VM202 족부궤양 관련 임상 2상에서 중증 하지허혈(CLI)을 적응증 대상으로 삼았다가 적응증을 틀어 도전한 것도 이와 무관치 않다. 미국에서 임상 3상은 적응증 DFU로 조정해 시험계획을 승인받은 현재로서도 여전히 해당 적응증 임상을 전문적으로 수행할 CRO가 부족한 것으로 확인된다.
당분간은 방향을 틀어 중국에서 추진하던 임상 3상에 초점을 맞출 가능성이 높아보인다. 파트너사인 베이징 노스랜드 바이오텍(Beijing Northland Biotech)이 진행하는 임상 3상은 총 2건이다. 각각 휴지기 통증 동반 중증하지허혈증 환자 300명, 궤양 동반 중증하지허혈증 환자 240명 대상 두 개의 임상이다.
헬릭스미스 관계자는 "중국에서 임상 3상 중인 중증하지허혈은 궤양과 통증으로 나눠 진행 중이며 궤양에 대해서는 3상을 마치고 분석 중"이라며 "결과가 좋게 나오면 미국에서도 임상을 추진할 텐데 시기는 올해 예산과 상황을 고려해 바이오솔루션과 상의해 결정할 것"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [북미 질주하는 현대차]윤승규 기아 부사장 "IRA 폐지, 아직 장담 어렵다"
- [북미 질주하는 현대차]셀카와 주먹인사로 화답, 현대차 첫 외국인 CEO 무뇨스
- [북미 질주하는 현대차]무뇨스 현대차 사장 "미국 투자, 정책 변화 상관없이 지속"
- 수은 공급망 펀드 출자사업 'IMM·한투·코스톤·파라투스' 선정
- 마크 로완 아폴로 회장 "제조업 르네상스 도래, 사모 크레딧 성장 지속"
- [IR Briefing]벡트, 2030년 5000억 매출 목표
- [i-point]'기술 드라이브' 신성이엔지, 올해 특허 취득 11건
- "최고가 거래 싹쓸이, 트로피에셋 자문 역량 '압도적'"
- KCGI대체운용, 투자운용4본부 신설…사세 확장
- 이지스운용, 상장리츠 투자 '그린ON1호' 조성
최은수 기자의 다른 기사 보기
-
- [Board change]합병 앞둔 한화인더스트리, '비전 C레벨' 이사회 합류
- [캐시플로 모니터]한화오션, 2조 유증에도 아쉬운 현금흐름 '또 차입'
- DB금투, '약식명령'에 저축은행 대주주 적격성 흔들
- [CFO 인사 코드]'변화대신 안정' 미래에셋그룹, 재무라인 교체 '없었다'
- [On the move]'그룹 넥스트' 찾는 삼성물산, '신사업 팔방미인' 공채
- 명륜진사갈비의 '변신을 위한 용기'
- [2024 이사회 평가]'AI 투자회사 변신' SK네트웍스, 힘 보태는 이사회
- [2024 이사회 평가]'사내이사 없는 이사회 고수' 한샘, 참여도만 '우수'
- [조달전략 분석]포스코홀딩스, 급전 융통 창구된 '해외 계열사 지분'
- [Board change]'보험 키맨' 필요했던 롯데손보, 금감원 출신 영입
























