고바이오랩, 상장 발판 아시아 넘어 글로벌 '빅3' 포부 [IPO 기업분석]마이크로바이옴 신약 개발 '각광'...성공률 높은 임상개발, 현실화 목표
최석철 기자공개 2020-10-28 13:46:24
이 기사는 2020년 10월 26일 15:43 thebell 에 표출된 기사입니다.
고바이오랩이 IPO를 앞두고 내세우는 최대 강점은 마이크로바이옴 신약 개발 분야의 선두 그룹에 근접해 있다는 점이다. 더 나아가 글로벌 '빅3'로 입지를 다지겠다는 포부다.신약 기술 분야에서 국내 제약·바이오기업은 절대적인 후발주자다. 하지만 상대적으로 뒤늦게 조명을 받고 있는 마이크로바이옴 분야에서는 글로벌 경쟁사와 비교해 기술 격차가 상대적으로 적다는 평가다.
다른 신약 개발 프로세스와 비교해 임상 단계에서 소용되는 비용과 시간이 절반 수준에 불과하기 때문에 신약 개발에 대한 리스크도 비교적 낮은 축에 속한다.
◇글로벌 마이크로바이옴 치료제 상용화 경쟁...고바이오랩, 기술력 '자부심'
26일 업계에 따르면 고바이오랩은 마이크로바이옴 기술을 활용해 아토피 피부염, 천식, 당뇨, 비만, 간 질환, 우울증, 자폐증 등의 치료제를 개발하고 있다. 많은 이들이 앓고 있지만 예방이 어렵고 치료에 많은 시간과 비용이 드는 만성질환이다.
휴먼 마이크로바이옴 기술은 인체에 무해한 장내 미생물(장 속에 사는 미생물) 중 특정 질환에 긍정적인 영향을 끼치는 균주를 추출해 질병 예방과 치료에 활용하는 방식이다.
마이크로바이옴은 최근 바이오·제약업계에서 각광받고 있는 분야다. 2010년을 전후로 학술적 연구가 본격화됐으며 10년이 지난 지금 연구 결과를 바탕으로 신약의 시장성은 점차 밝아지고 있다.
미국 시장조사전문기관 BCC에 따르면 글로벌 마이크로바이옴 치료제 시장은 2019년 약 1억4000만달러 규모에서 연평균 131.2% 성장해 2024년 약 94억 달러 규모가 될 것으로 전망됐다.
다만 아직까지 마이크로바이옴 신약은 상용화된 제품이 없다. 글로벌 제약사들이 초기 시장 선점을 위한 치열한 경쟁을 벌이고 있는 가운데 가장 앞서있는 곳은 미국 세레스 테라퓨틱스다.
세레스 테라퓨틱스(Seres Therapeutics)는 감염성 장염(클로스트리듐 디피실 감염증)을 적응증으로 하는 치료제 후보물질로 임상3상을 마쳤다. 앞으로 미국 FDA의 신약허가신청을 거쳐 빠르면 2021년 제품 상용화에 성공할 것으로 보인다.
미국 나스닥에서 세레스 테라퓨틱스의 주가는 임상3상 결과가 알려진 뒤 4달러 내외에서 26달러 내외로 6배 이상 급등하기도 했다.
베단타 바이오사이언시스(Vedanta Biosciences)도 마이크로바이옴 기술 측면에서 선두를 다투는 기업으로 꼽힌다. 지난해 시리즈C-1(455만 달러)과 시리즈C-2(1660만 달러) 투자를 잇달아 성사시키며 이목을 집중시켰다.
현재 음식 알레르기, 항암, 염증성 장 질환, 감염성 장염 등의 치료제로 각각 임상2상과 임상1상 등의 단계를 진행하고 있다.
이 밖에 리바이오틱스와 에이오바이옴, 오셀(이상 미국), 옥스테라(스웨덴)가 마이크로바이옴 치료제로 각각 미국과 유럽 등지에서 임상3상을 진행하고 있다.
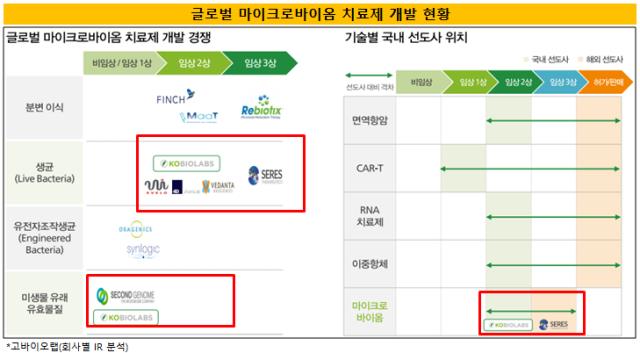
아시아에서는 고바이오랩이 유일하게 마이크로바이옴 신약으로 임상2상을 진행하며 선두에 서있다. 신약 개발 기술 측면에서는 여느 글로벌 경쟁사와도 견줄만하다는 자신감을 내비치고 있다.
고바이오랩은 올해 8월 미국식품의약국(FDA)로부터 마이크로바이옴 기반 건선 치료제 ‘KBLP-001'의 임상2상 시험 계획을 최종 승인 받고 미국과 호주, 국내 등에서 각각 임상2상을 진행하고 있다.
2022년 임상2상을 마치고 임상3상에 진입하겠다는 계획이다. 빠르면 2024년 이후에 제품 상용화에 성공할 것으로 전망됐다.
이 밖에 아토피 피부염과 천식, 궤양성 대장염 등을 적응증으로 하는 파이프라인별 사업계획을 토대로 2025년까지 마이크로바이옴 신약 개발 글로벌 ‘빅3’로 자리매김하겠다는 목표다.
◇일반 신약 대비 안정성 검사 유리...‘천상 학자’ 고광표, 진두지휘
국내에 다수의 신약 개발사들이 있지만 실제 성과를 거둔 기업은 많지 않다. 그만큼 신약 개발이 쉽지 않다는 뜻이다. 반면 고바이오랩은 글로벌 기업과 기술격차가 크지 않은 만큼 충분히 어깨를 나란히 할 만하다는 자신감을 내비치고 있다.
마이크로바이옴 신약이 상대적으로 다른 신약과 비교해 임상에 소요되는 비용과 시간이 상대적으로 적게 든다는 점도 치료제 상용화까지의 불확실성을 낮춰주는 요인으로 꼽힌다. 전통적 신약 대비 개발과정은 약 2년 이상 단축할 수 있으며 개발비용도 절반 수준에 그치는 것으로 평가된다.
처음부터 인체에 살고 있는 미생물을 토대로 하는 만큼 독성시험이 면제되거나 간소화되기 때문이다. 또 연구개발에 실패하더라도 다른 물질로 빠르게 대체해 다시 임상에 진입할 수 있다.
2013~2015년 기준으로 신약개발사들의 안전성에 따른 임상 실패 비중은 전체 임상 실패의 25%에 달한다. 이를 감안하면 마이크로바이옴 치료제의 임상 성공 확률은 그만큼 높아지는 셈이다.
고바이오랩 역시 지난해 9월 호주에서 마이크로바이옴 기반 건선 치료제 ‘KBLP-001'의 임상1상 시험 승인을 받은 뒤 9개월만에 임상1상을 마쳤다. 통상 신약 임상1상이 1년 반가량 걸리는 것을 감안하면 빠른 속도다.
고바이오랩을 진두지휘하는 것은 고광표 각자 대표이사다. 2011년 서울대학교에 국내 최초 마이크로바이옴 센터를 세우고 '국제 인체 마이크로바이옴 컨소시엄'에 세계 8번째이자 한국 대표로서 정회원으로 가입하는 등 마이크로바이옴 관련 국제적인 역량과 인지도를 보유하고 있다.
2011년 하버드대학교과 MIT의 Broad Institute of MIT and Harvard에서 연구원으로 일하며 지금의 세레스테라퓨틱스, 베단타 등을 이끌고 있는 이들과 함께 연구한 바 있다. 지금도 미국, 독일 등지의 글로벌 제약사, 연구기관, 대학 연구소 등과 끈끈한 글로벌 네트워크를 맺고 있다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 수은 공급망 펀드 출자사업 'IMM·한투·코스톤·파라투스' 선정
- 마크 로완 아폴로 회장 "제조업 르네상스 도래, 사모 크레딧 성장 지속"
- [IR Briefing]벡트, 2030년 5000억 매출 목표
- [i-point]'기술 드라이브' 신성이엔지, 올해 특허 취득 11건
- "최고가 거래 싹쓸이, 트로피에셋 자문 역량 '압도적'"
- KCGI대체운용, 투자운용4본부 신설…사세 확장
- 이지스운용, 상장리츠 투자 '그린ON1호' 조성
- 아이온운용, 부동산팀 구성…다각화 나선다
- 메리츠대체운용, 시흥2지구 개발 PF 펀드 '속전속결'
- 삼성SDS 급반등 두각…피어그룹 부담 완화
























