신풍제약, 허혈성 뇌졸중치료제 연내 임상2b상 돌입 9월중 IND 신청…통계적으로 유효성 입증 위해 임상 규모 100명 이상
강인효 기자공개 2018-09-03 08:05:59
이 기사는 2018년 08월 31일 15시31분 thebell에 표출된 기사입니다
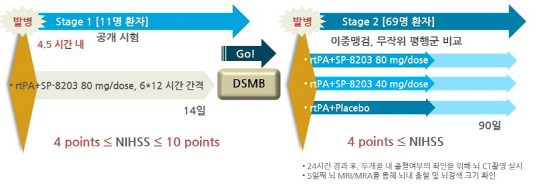
신풍제약이 혁신 신약(first-in-class)으로 개발 중인 허혈성 뇌졸중 치료제가 연내 국내 임상 2b상에 돌입한다. 앞선 임상 2a상에서 안전성뿐만 아니라 효능을 확인한만큼 이번 후기 임상에서는 통계적으로 유효성 입증에 중점을 두고 개발 속도에 박차를 가한다는 계획이다.31일 제약업계에 따르면 신풍제약은 9월 중으로 식품의약품안전처에 자체 개발하고 있는 허혈성 뇌졸중 치료제 'SP-8203(개발명)'의 임상 2b상에 대한 임상시험계획(IND)을 신청할 예정이다. IND 신청 후 승인까지 통상적으로 한 달 가량이 소요되는 것을 감안할 때 SP-8203의 임상 2b상은 늦어도 11월부터 시작될 것으로 예상된다.
업계에선 신풍제약이 SP-8203의 임상 2a상에서 이 약의 안전성을 이미 확인한 만큼 임상 2b상을 통해 유효성을 입증하는데 주력할 것으로 보고 있다. 임상 2a상의 경우 국내 8개 주요 대학병원에서 80명을 대상으로 진행됐는데 이번 임상 2b상에서는 통계적으로 유효성에 대한 유의미한 결과도 도출하기 위해 임상 환자 규모도 100명을 넘을 것으로 전망된다.
신풍제약 관계자는 "당초 후기 임상은 환자 120명을 모집해 위약군(대조군)과 투여군(실험군) 각각 60명씩 비교하는 방식으로 디자인했다"면서도 "아직까지 임상 2b상과 관련한 프로토콜을 논의하고 있는 단계여서 정확한 임상 규모는 정해지지는 않았지만 임상 2a상보다 커질 것으로 본다"고 말했다.
이어 "임상 2b상도 2a상과 마찬가지로 투약 후 환자 관찰 기간을 90일로 동일하게 가져갈 것"이라며 "지난해 12월 완료된 임상 2a상 이어 빠르게 임상 2b상을 진행하는 것은 투여군 규모를 대폭 늘려 임상 2a상(투여군 24명으로 40㎎/dose·저용량군)에서 입증된 SP-8203의 유효성을 통계적으로 확인하는 것이 목표"라고 덧붙였다.
세계보건기구(WHO)에 따르면 허혈성 뇌졸중은 세계 사망 원인 2위 질환이다. 세계 허혈성 뇌졸중 치료제 시장 규모는 오는 2020년까지 약 2조3000억원에 달할 것으로 추정된다.
현재 허혈성 뇌졸중 치료제로는 tPA(정맥 투여용 혈전용해제)인 독일 제약사 베링거인겔하임의 '액티라제'가 유일하다. 신풍제약이 개발 중인 SP-8203은 뇌혈관이 막히는 허혈성 뇌졸중과 이 질환의 유일한 치료제인 tPA의 부작용을 동시에 차단해 출혈률과 사망률을 대폭 감소시킨 혁신 신약이다.
신풍제약 관계자는 "비임상(동물실험)에서 tPA와 SP-8203과의 병용 투여시 tPA에 의해 유발되는 부작용을 억제하는 효과가 입증됐다"며 "이어 진행한 임상 1상에서 안전성을, 임상 2a상에서 유효성까지 확인한 만큼 임상 2b상을 신속하게 진행해 SP-8203의 효능도 통계적으로 입증할 것"이라고 말했다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [i-point]'FSN 계열' 두허브, 마이원픽 월간 신규 가입자 급증
- 아트와 파이낸스는 대척점에 있을까
- [네패스그룹은 지금]승계 정공법 택한 오너일가, 상속세 '250억' 육박
- [강소 전선업체 리포트]대원전선, 실적 성장세 '견조' vs 운전자본·주가 '부진'
- [비상장 게임사 도전기]4년 만에 돌아온 라이온하트, '성공 DNA' 증명 분수령
- '퐁피두 키우기' 한화문화재단, 이성수 신임 대표 선임
- [Company Watch]KT밀리의서재, R&D 조직 개편…플랫폼 고도화·AI '집중'
- [Company Watch]'쉼 없는 공장가동' 삼성메디슨, 소니오 정상화는 '요원'
- 삼성 준감위, 이재용 소통 지속 '정치적 독립 초점'
- 대표 떠난 SK쉴더스, 임현수 CFO '대행 체제' 출범