[클리니컬 리포트]이엔셀 EN001, '근육·신경' 재생으로 희귀질환 공략샤르코마리투스도 1b상 IND 승인…상업화 약물없어 2상 이후 조건부허가 가능
홍숙 기자공개 2023-09-27 09:23:40
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2023년 09월 26일 07:23 thebell 에 표출된 기사입니다.
이엔셀이 줄기세포치료제 기반 희귀질환 약물 개발을 위한 임상에 진입했다. 듀센근위축증(DMD)에 이어 샤르코마리투스(CMT)로 적응증을 확장하며 개발에 속도를 내고 있다. 두 질환 모두 근본적인 치료제가 없어 조건부 품목허가를 통해 조기 상용화가 가능할 것으로 보인다.◇EN001, CMT 대상 임상 1b상 IND 승인...임상 2상 통해 조건부품목허가 가능
이엔셀은 19일 식품의약품안전처로부터 EN001의 CMT 임상 1b상에 대한 임상시험계획(IND)을 승인받았다. 앞서 안전성과 내약성을 평가하는 임상 1상은 CMT 환자 12명을 대상으로 이뤄졌다. 이번에 승인된 임상 1b상은 반복투여를 통한 안전성과 유효성을 평가한다는 계획이다.
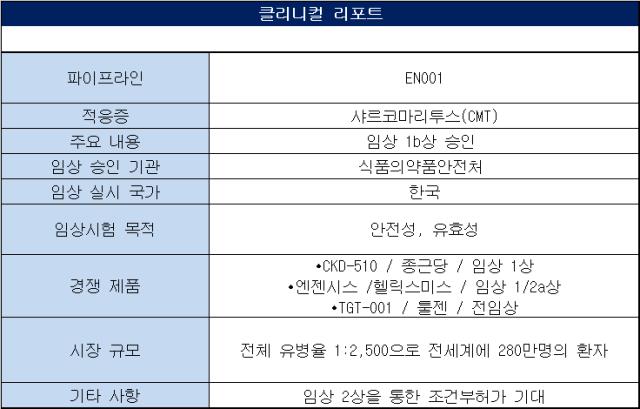
EN001은 자체 배양 기술을 활용해 동종탯줄유래중간엽 줄기세포 치료제 후보물질이다. 중간엽줄기세포는 탯줄, 고수, 지방 등의 조직에서 추출한 성체 줄기세포다. 이를 통해 신경 수초와 근육 재생을 돕는다는 전임상 결과를 논문을 통해 발표했다.
이엔셀은 임상 1상에서 안전성을 입증한 결과를 바탕으로 일부 유효성 검증을 위해 임상 1b상을 수행한다. 아직 식약처를 통해 임상 1b상 세부 설계 내용은 공개되지 않았다. 다만 임상 1b상 역시 임상 1상의 규모와 유사하게 진행될 것으로 전망된다.
1b상에서 주요하게 살펴봐야 할 지표는 '유효성'이다. 당장 임상 2상 결과만으로 상업호가 가능한 CMT 약물 임상의 특성상 1b상에서 유효성을 입증하는 것이 관건이다.
CMT의 유효성을 가늠할 수 있는 지표로는 FDS(기능장애척도), ONLS(전반적 신경장애 한계 척도), CMTNS-v2(CMT 신경병 점수 v2) 등이 있다. 이에 따라 EN001의 임상 1b상에도 해당 평가 지표가 다수 포함될 것으로 예상된다.
현재 CMT는 근본적인 치료제가 없는 상황이다. 때문에 식약처 등 규제당국과 논의를 통해 임상 2상만으로도 품목허가(NDA) 신청이 가능하다. 이엔셀은 이런 제도를 활용해 조기 상용화도 추진한다는 계획이다.
이엔셀 관계자는 "이번 1b상 임상시험에서는 CMT 환자에게 총 2번의 반복 투여를 통해 안전성과 유효성을 확인할 예정"이라며 "임상 결과에 따라 조건부 품목허가를 비롯한 가속승인을 기대하고 있다"고 말했다.
◇'삼성가 유전질환'으로 알려진 CMT, 근본 치료제 없어...종근당·노바티스 등 관심
CMT는 현재까지 치료제가 전무한 대표적인 난치성 유전 질환이다. 현재까지 약 70여가지의 원인유전자가 규명됐다. 하지만 아직까지 전체 환자의 절반의 환자는 원인유전자조차 규명되지 않았다.
현재까지 규명된 바로는 PMP-22 등 특정 유전자의 중복으로 손이나 발, 말초신경의 정상적인 발달이 저하되는 게 대부분이다. 흔히 손이 굽고 마비가 오며 국내에선 삼성 일가의 유병 사례가 알려지며 유명세를 탔다. EN001를 비롯해 대부분의 CMT 파이프라인은 여러 CMT 가운데 1A형을 타깃한다.
국내에서는 이엔셀에서 앞서 종근당이 저분자화합물로 해당 질환에 대한 임상 1상을 마쳤다. 종근당은 히스톤탈아세틸화효소6(HDAC6)를 저해하는 비하이드록삼산 플랫폼 기술을 이용해 CKD-510를 샤르코마리투스 치료제로 개발하고 있다. 87명을 대상으로 한 임상 1상을 유럽 임상을 마무리하고 올해 안으로 미국에서 임상 2상을 진입한다는 계획이다.
유전자치료제를 활용한 개발도 활발하다. 국내 기업 중 툴젠과 헬릭스미스가 대표적이다. 툴젠은 TGT-001을 대상으로 전임상을 진행 중이며 내년에 임상 1상 진입을 목표로 한다. 헬릭스미스는 엔젠시스(VM202)을 통해 임상 1/2a상을 완료하며 안전성과 일부 유효성을 입증한 상황이다.
글로벌제약회사 중에는 노바티스가 CMT 파이프라인에 관심을 보이고 있다. 이러한 활동을 일환으로 노바티스는 올해 7월 siRNA 치료제 개발사 미국 바이오텍 Dtx 파마(DTx Pharma)를 인수했다. 주요 CMT 파이프라인으로 DTx-1252(전임상)가 있다. 해당 파이프라인은 PMP22의 과발현을 유발하는 CMT1A의 근본 원인을 표적한다. 최근 FDA로부터 희귀의약품 지정을 받았다.
제약바이오 업계 관계자는 "CMT는 아직까지 근본적인 치료제가 개발되지 않은 만큼 국내 기업도 충분히 개발해 볼 만한 질환 영역"이라며 "소규모 임상과 신규 모달리티로 충분히 신약 개발에 임해 볼 만한 분야"라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- '노랑통닭 운영' 노랑푸드 매각 착수, 삼정KPMG 맞손
- [달바글로벌은 지금]유가증권시장 향하는 뷰티기업, 에이피알 '판박이' 전략
- 삼성·키움까지…증권사 VC 협회 릴레이 가입 '왜'
- 코스포, 일본 진출 조력자로…현지 답사 첫 진행
- [VC 투자기업]씨너지, 132억 프리A 브릿지 투자 유치
- [아이지넷, Road to IPO]'보험+핀테크' 결합…인슈어테크 1호 상장 노린다
- [VC 투자기업]빅오션이엔엠, 뮤지컬 제작사 T2N미디어 인수
- 한화생명, 대규모 후순위채 발행…HUG 금리 여파 '촉각'
- HS효성첨단소재, 3년만에 '공모채' 노크…차입만기 늘린다
- [IB 풍향계]위기설 '해프닝' 롯데, 조달 전선 영향은

























