[암 유도 미사일, 'RPT' 시장의 개화]퓨쳐켐·셀비온, 국내 선두 놓고 경쟁…포인트 다른 2상 결과⑦효능 비교는 어려운 시점, 부작용 측면에서 '셀비온' 우세
김진호 기자공개 2024-10-28 08:30:50
[편집자주]
유도미사일처럼 암세포에만 정확하게 도달해 공격하는 약물 기술이 있다면. 이 같은 개념을 구현한 게 항체-약물 접합체(ADC)다. 그리고 이를 이을 차세대 기술로 방사성 동위원소를 암세포에 직접 전달해 파괴하는 방사성 치료제(RPT)가 주목받고 있다. RPT 파이프라인을 확보하려는 빅파마들의 조단위 M&A 등의 거래가 이어지고 있고 국내 기업도 앞다퉈 관련 시장에 진출하고 있다. 시장 현황과 국내사들의 전략을 더벨이 짚어봤다.
이 기사는 2024년 10월 25일 07:46 thebell 에 표출된 기사입니다.
방사성의약품 기반 전립선암 치료제 후발 기업으로 국내 퓨쳐켐과 셀비온이 주목받고 있다. 양사 모두 해당 분야에 최초로 진출한 스위스 노바티스의 ‘플루빅토’를 따라잡기 위한 임상 2상이 한창이다.퓨쳐켐은 플루빅토 대비 절반 용량으로 그 이상의 효능을 확인하는 데 집중하고 있다. 셀비온은 보다 안전하다는 강점을 부각한다. 양사간 '국내 최초의 방사성 리간드 신약 개발사'라는 타이틀을 얻기 위한 막바지 속도 경쟁이 불붙고 있다.
◇플루빅토의 성공 신화로 방사성 리간드 신약 주목
글로벌 빅파마 노바티스의 플루빅토(성분명 177Lu-PSMA-617)는 '거세 저항성 전립선암'(mCRPC) 치료 적응증으로 미국식품의약국(FDA)과 유럽의약품청(EMA)으로부터 각각 2022년 4월과 12월에 품목허가 승인을 득해 세상에 출시됐다.
특정 암세포에 결합하는 리간드와 방사성 동위원소를 결합한 약물이다. 플루빅토는 미국 기준 2013년에 승인된 최초의 방사선 리간드 치료제였던 ‘조피고’(성분명 라듐-223염화물)에 이어 동종 약물 중 두 번째로 시장에 등판했다.
플루빅토는 조피고 대비 폭넓은 활용성으로 주목받았다. 조피고의 경우 내장전이 없이 골 전이된 mCRPC 환자에 국한돼 쓰였다. 반면 플루빅토는 내장을 포함해 체내 다른 부위로 전이된 mCRPC 환자 모두에게 적용할 수 있다.
플루빅토의 매출은 출시국 확대에 발맞춰 지난해 9억8000만 달러(한화 약 1조3500억원)로 전년 대비 261%가량 치솟았다. mCRPC 환자는 1차 치료단계에서 탁셀계열 항암제를, 2차 치료 단계에서 항안드로겐제를 사용한다. 미국 화이자와 일본 아스텔라스가 공동개발한 ‘엑스탄디’(성분명 엔잘루타마이드)가 대표적인 항안드로겐제다.
플루빅토는 3차 치료 단계의 mCRPC 환자에게 쓰인다. 말기 mCRPC 환자에서 점으로 산포돼 나타나는 암세포들은 수술로 제거할 수 없다. 이를 표적해 공격하는 방사성 리간드 치료제가 대안으로 작용하고 있는 셈이다.
효능이 각광받으면서 한국 식품의약품안전처도 올해 5월 mCRPC 적응증으로 플루빅토를 승인했다. 미국과 한국에서 플루빅토 1병(바이알)의 가격은 3000만원 안팎이다.
◇셀비온, 부작용 측면에서 퓨쳐켐 대비 강점 확보
플루빅토를 따라잡기 위한 동종 신약 임상을 수행 중인 퓨쳐켐과 셀비온에 대한 관심으로 이어지고 있다. 양사 모두 자체 후보물질의 국내 임상 2상을 진행 중이다. 특히 셀비온은 연내 조건부허가 신청을 완료할 것을 예고하고 있다.
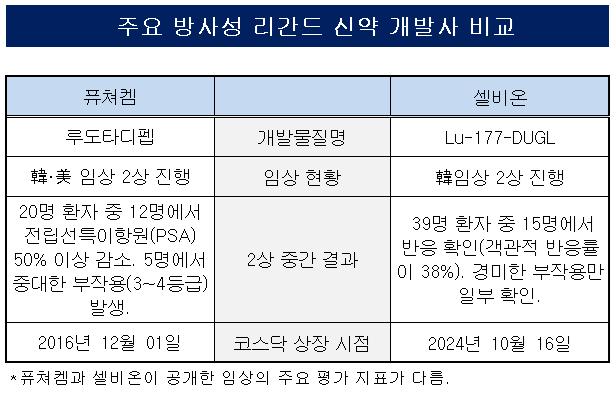
퓨쳐켐은 방사성리간드 신약 후보물질 ‘루도타디펩’(개발명 FC705)에 대해 mCRPC 대상 한국과 미국에서 동시에 임상 2상을 수행하고 있다. 루도타디펩은 알부민을 추가해 체내 체류 시간을 늘린다.
퓨쳐켐은 9월 FC705의 국내 임상 2상에 대한 중간 결과를 내놨다. FC705를 투여한 20명의 환자 중 12명에서 전립선특이항원(PSA) 수치가 50% 이상 낮아진 것으로 확인됐다. 이 중 3명의 환자에게 PSA가 사라졌지만 5명의 환자에게는 3~4등급의 중대한 부작용이 나타났다. 항암 신약 개발 분야에서 3등급 이상의 부작용은 해당 약물의 치료를 중단해야 하는 것으로 통한다.
퓨쳐켐 관계자는 “루도타디펩은 플루빅토 대비 절반의 용량으로도 높은 효능을 낼 것으로 기대된다”며 “원료인 방사성동위원소 사용을 줄일 수 있기 때문에 단가를 낮춰 시장에 공급할 수 있다”고 말했다.
이에 대항하는 셀비온은 7월 방사성 리간드 신약 후보물질 ‘Lu-177-DUGL’에 대해 총 91명의 mCRPC 환자를 대상으로 국내 임상 2상 투약을 완료했다. 해당 임상 환자 수는 61명으로 예정됐지만 많은 사람이 몰려 그 수가 30명 더 늘었다.
셀비온이 지난달 내놓은 Lu-177-DUGL의 2상 중간 결과에서 퓨쳐켐과 달리 객관적반응률(ORR) 지표를 들고 나왔다. 39명의 mCRPC 환자 중 15명에서 반응이 관찰돼 ORR이 38%로 확인됐다.
또 Lu-177-DUGL 투약군에서 호중구 또는 혈소판 등 혈액 독성은 0~4.8%, 구강건조는 13.3%였다. 해당 투약군에서 중대한 부작용은 나타나지 않았다.
이에 대해 셀비온은 Lu-177-DUGL에서 친수성으로 간에서 대사를 거치지 않으며 빠르게 소변으로 나와 체내 잔존시간이 짧다는 것을 강조하고 있다. 방사성 동위원소의 체내 잔존시간이 늘면 부작용 발생할 확률도 높아진다는 설명이다.
셀비온 관계자는 “중대한 부작용도 없고 다른 부작용도 플루빅토보다 낮게 관찰되고 있다”며 “효능과 함께 안전한 약물인 점을 인정받아 시장에 진출하겠다”고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [코스닥 상장사 매물 분석]외형 줄어든 디티씨, 루멘스 인수 돌파구 기대
- [Company Watch]'유해사이트 차단' 플랜티넷, 3분기 실적 개선세 뚜렷
- [현장 인 스토리]세림B&G, 친환경 생분해 플라스틱 도약 준비 '끝'
- 'IPO 출사표' 와이즈넛, 3000억대 몸값 제시 '투심 관건'
- 폴라리스오피스의 '성공적' M&A 행보
- [PMI 포럼 2024]"불확실성 높은 빅컷 시대, LP-GP간 활발한 소통 필수"
- [PMI 포럼 2024]"미 헬스케어 시장 개편 한창, 국내 투자자엔 기회"
- [PMI 포럼 2024]"적대적 M&A, 법률적 적법성부터 면밀히 판단해야"
- [PMI 포럼 2024]"승계 고민 깊어지는 PE들, LP 신뢰 유지 집중해야"
- [PMI 포럼 2024]"재활용업체 밸류업, 수직계열화·지역 거점화 중시해야"
김진호 기자의 다른 기사 보기
-
- 지아이셀, 'NK 확장성' 첫 성과 튀르키예 제약사 텀싯 체결
- 삼성바이오로직스, 항체·빅파마·지역 벌크업 다음은 ADC
- [오름테라퓨틱 IPO In-depth]'ORM-5029'의 SAE '환자모집' 중단, 성과 자신감은 그대로
- [클리니컬 리포트]SK바이오팜, 세노바메이트 활용법 '제형·적응증' 확장전략
- 티움바이오, SK 동맹이 만들어준 3년치 연구비용 '500억'
- [알테오젠 '제형변경' 플랫폼 줌인]'특허 피하고 신기술 만들고' 후발 등장에도 자신감 이유
- [알테오젠 '제형변경' 플랫폼 줌인]상용화 플랫폼 할로자임과 양강체제, '빅파마 잡아라' 경쟁
- 에이비온, 모기업 대상 200억 유증 '비보존' 지분 확보
- [바이오텍 유증·메자닌 승부수]압타머사이언스, 법차손 규제 피하기 '유증'…ApDC 속도전
- 강스템, 오스카 임상 '안전성에 유효성까지' 첫 기술이전
























