삼성 휴미라 바이오시밀러 국내 허가 신청 승인시 TNF 억제제 3종 모두 장착…35조 세계 시장 겨냥
이석준 기자공개 2016-09-26 08:11:46
이 기사는 2016년 09월 23일 14시40분 thebell에 표출된 기사입니다
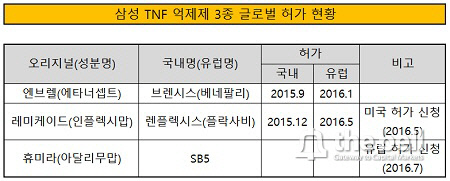
삼성바이오에피스가 최근 휴미라 바이오시밀러 SB5에 대해 국내 허가 신청을 한 것으로 확인됐다. 지난해 9월과 12월에 각각 승인받은 브렌시스(엔브렐 바이오시밀러), 렌플렉시스(레미케이드 바이오시밀러)에 이은 세번째 TNF 알파 억제제 자가면역질환치료제다.SB5가 허가를 받으면 삼성바이오에피스는 TNF 알파 억제제 3종(엔브렐, 레미케이드, 휴미라) 바이오시밀러를 한 국가에서 모두 승인받는 최초의 제약사로 이름을 올리게 된다. 나아가 35조 원 글로벌 시장 침투도 더욱 가시권에 들어오게 된다.
23일 업계에 따르면, 삼성바이오에피스는 8월말 SB5에 대해 국내 허가 신청서를 냈다. 이르면 내년 상반기 승인이 점쳐진다.
SB5 허가 데이터는 이미 갖춰진 상태다. 삼성바이오에피스는 지난해 SB5 글로벌 임상 3상에서 휴미라와 약효 동등성 확보에 성공했다고 밝혔다. 임상은 2014년 6월부터 13개월 동안 7개 국가 51개 병원에서 진행됐다.
지난 6월 런던 유럽류마티스학회(EULAR 2016)에서는 SB5의 오리지널 스위칭 3상 임상 결과를 발표했다. 스위칭 데이터는 기존 오리지널 시장을 대체할 때 근거를 제공하는 필수적인 자료다.
SB5 스위칭 임상은 메토트렉세이트(MTX) 사용 후에도 증상이 개선되지 않은 중등도~중증 류마티스 관절염 환자 중 투약 첫 24주를 마친 508명을 대상으로 52주까지 진행했다.
첫 24주 동안 오리지널 제품 투여군 129명은 휴미라를 그대로 유지하고, 125명은 오리지널에서 SB5로 스위칭했다. 첫 24주 동안 SB5를 투여 받은 환자 254명은 24주 이후에도 지속적으로 SB5를 투여해 52주까지 추가 임상을 진행했다.
52주 후 SB5 유지 투여군은 ACR20(투약 후 통증 20% 개선도를 평가하는 지표) 76.9%, 오리지널에서 SB5 스위칭군 81.1%, 오리지널 유지 투여군 71.2%로 유효성 면에서 유의한 차이가 없었다. 안전성이나 면역원성 역시 유사했다.
국내에서 SB5가 허가 받게 되면 삼성바이오에피스는 TNF 알파 억제제 3종(엔브렐, 레미케이드, 휴미라) 바이오시밀러를 한 국가에서 모두 허가받는 최초의 제약사가 된다.
삼성바이오에피스 관계자는 "본격적으로 시판에 돌입할 경우 삼성바이오에피스는 3가지 제품을 모두 공급할 수 있어 다른 회사가 따라올 수 없는 차별적인 경쟁력을 보여 줄 수 있을 것"이라고 말했다.
고 기대했다.
한편 삼성바이오에피스는 TNF 억제제 3종에 대해 선 유럽 진출 후 미국 침투 전략을 세우고 있다. 현재 브렌시스(유럽명 베네팔리)와 렌플렉시스(플락사비)가 각각 올 1월과 5월 유럽 의약품청(EMA) 승인을 받았다. 렌플렉시스는 지난 5월 미국 식품의약국(FDA)에, SB5는 두 달 후인 7월 EMA에 시판 허가를 요청했다. 전세계 TNF 알파 억제제 3종 매출액은 35조 원 가량이다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 글랜우드PE, 3호 펀드 1조 규모로 내달 1차 클로징
- [i-point]미래아이앤지 "단순 세무조사 진행 중"
- [Deal Story]SK네트웍스, 렌터카 매각에도 공모채 투심 견조했다
- [Deal Story]세아제강, 3년물 회사채 흥행 이어갔다
- [Deal Story]LX인터, 복귀전서 1조 수요…언더금리 확보
- [한화그룹 승계 로드맵 점검]그룹내 자금 에어로 투입, 투자자 달랠수 있을까
- '첫 선' 모태 과기부 AI 출자, 정시 서류탈락자 '북적'
- [윤석열 대통령 탄핵]UAE국부펀드, '토종 헤지펀드' 출자 속도낸다
- [thebell note]리브스메드, 한국의 포드될까
- IPO 개선안에 코벤·하이일드펀드 투자자 불만 고조