녹십자 '면역글로불린' 美 진출 9부 능선 [라이선스 아웃 프리뷰]오창 공장 FDA 실사 마무리…연내 허가·내년 판매 가닥
이석준 기자공개 2016-08-12 08:05:15
[편집자주]
지난해 한미약품의 대규모 기술수출 이후 라이선스 아웃은 황금알을 낳는 거위로 주목받고 있다. 기술(신약후보물질)만 있으면 누구든 '퀀텀 점프'가 가능해졌다. 누가, 언제, 어느 규모로 라이선스 아웃 행렬에 동참할지, 제2의 한미약품을 찾는 투자자들의 발걸음이 분주하다. 주요 제약사 파이프라인을 중간 점검하고, 기술 수출 가능성을 가늠해본다.
이 기사는 2016년 08월 10일 15시13분 thebell에 표출된 기사입니다
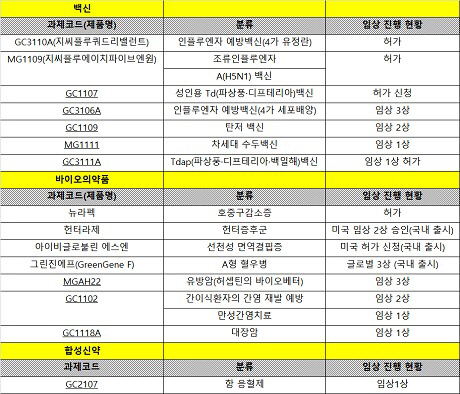
국내 시장에서 오랜 내공을 쌓은 녹십자 면역글로불린(IVIG-SN)이 미국 진출 9부 능선에 도달했다. 지난 6월 진행된 오창 공장 실사(미국 수준 우수의약품 제조·관리 기준, cGMP)가 긍정적으로 마무리된 것으로 알려지면서 이르면 연말 미국 판매 승인이 점쳐지고 있다. 미국은 글로벌 면역글로불린제제(약 4조1000억 원) 시장의 절반 이상을 차지하는 북미 시장의 핵심이다.미국 진출을 위한 임상 데이터는 준비된 상태다. IVIG-SN은 원발면역결핍증 환자를 대상으로 2011년부터 2013년 말까지 미국 9개 병원과 캐나다 2개 병원에서 진행한 북미 3상 임상을 성공적으로 끝마쳤다. 이 결과는 지난해 국제학술지 림포사 저널(LymphoSign Journal)에 게재됐다.
IVIG-SN은 2015년 11월 미국 식품의약국(FDA) 생물학적제제 품목허가 신청서(BLA)를 제출했고 올 1월 예비심사를 통과했다. 예비심사는 품목 허가 검토의 전 단계로 FDA는 60일간의 예비심사를 통과한 품목에 대해서만 허가 신청 자료를 검토한다. 녹십자는 FDA 허가 검토가 올 4분기 중에 완료될 것으로 예상하고 있으며 늦어도 2017년에는 미국 제품 출시가 가능할 것으로 보고 있다.
업계 관계자는 "생물학적제제의 경우 임상도 중요하지만 공장의 GMP 실사도 매우 중요하다"며 "녹십자 오창 공장이 면역글로불린 관련 FDA 실사를 큰 이슈 없이 마친 것으로 알려져 미국 진출을 위한 9부 능선을 넘었다"고 분석했다.
|
캐나다 진출 작업도 순조롭다. IVIG-SN은 지난 3월 캐나다 보건당국으로부터 임상 3상 승인을 받았다. 녹십자는 2018년 상반기 임상 3상 결과를 당국에 제출할 계획이다.
IVIG-SN 북미 시장 진출이 가시화되면서 녹십자는 생산시설도 증설하고 있다. 최근 오창공장 총 혈장처리능력을 기존의 2배인 연간 최대 140만ℓ 규모로 늘렸다. 여기에 연간 30만ℓ의 혈장처리가 가능한 중국공장과 연내 완공을 앞둔 100만ℓ 규모의 캐나다 공장 건립이 마무리되면 총 270만ℓ 규모의 혈장처리능력을 갖추게 된다. 세계 5위권 규모다. 녹십자는 지난 5월 오창공장 등 생산 시설 증설을 위해 창립 이래 첫 회사채를 발행했다.
면역글로불린 말고도 또 다른 바이오의약품 헌터증후군치료제 헌터라제와 A형 혈우병약 그린진에프에 대해서도 글로벌 진출을 시도하고 있다.
헌터라제의 경우 앞으로 미국 임상 2상에서 유일한 경쟁약인 엘라프라제 투여 용량(체중kg당 0.5mg)보다 두 배(1.0mg)와 세 배(1.5mg)로 늘렸을 때의 효과를 탐색하고 안전성을 검증한다. 고용량 투여가 가능하다 것은 안전하면서도 치료 효과는 높인다는 의미로 성공할 경우 엘라프라제와 차별성을 꾀할 수 있다. 미국에서 앞서 허가 받은 엘라프라제는 체중kg당 0.5mg 투여만 가능한 상태다.
그린진 에프는 2013년 2월 미국 식품의약국(FDA)과 유럽 의약품청(EMA)의 임상 3상 진입을 승인 받고 현재 미국, 영국, 캐나다, 러시아, 뉴질랜드 등에서 글로벌 임상 3상을 진행 중이다,.
녹십자는 이외도 신약 후보 물질이 여럿 존재한다. B형 간염 바이러스를 중화하는 항체 GC1102는 세계 최초로 간이식 환자를 대상으로 임상 2상을 마쳤고, 만성B형간염 환자를 대상으로 임상 1상을 시작했다. 대장암을 타깃으로 하는 항체치료제 GC1118은 기존 치료제와 차별화된 기전을 가진 항체로 임상1상을 진행 중이다. 다만 모든 분야에 투자할 수 없는 만큼 다른 제약사와의 다양한 제휴와 협업, 라이센싱 아웃 등을 모색하고 있다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사