브이티지엠피 자회사, 치매치료제 '임상 1상' 승인 ㈜브이티바이오 조절T세포 신약 VT301, 연내 美 FDA 임상도 추진
조영갑 기자공개 2020-09-01 10:19:22
이 기사는 2020년 09월 01일 10시18분 thebell에 표출된 기사입니다
코스닥 상장사 브이티지엠피의 자회사 ㈜브이티바이오가 개발하고 있는 치매치료제가 식품의약품안전처(식약처)로부터 임상 1상 승인을 받았다.㈜브이티바이오는 1일 서울대병원 정신건강의학과 연구팀과 공동으로 진행한 알츠하이머성 치매치료제 VT301 임상이 식약처로부터 1상 승인을 받았다고 밝혔다. 이번 임상은 중등도 알츠하이머병 환자를 대상으로 안전성 및 약물의 효능효과를 탐색하는 방식으로 진행됐다.
㈜브이티바이오는 자가세포를 이용한 조절 T세포 이식으로 알츠하이머병 치료제 연구개발과 동시에 건강기능식품, 샴푸 등의 생활건강 유통판매업을 영위하는 기업이다. 최근 천연물 치매치료제 PM012의 임상 2상을 완료하기도 했다.
㈜브이티바이오 관계자는 "전 세계에서 처음으로 진행된 조절T세포의 치매치료 임상이라는 의미가 있다"면서 "코로나19로 인한 임상 지연을 예방하기 위해 서울대병원의 임상시험심사(IRB)도 병행하고 있어 임상을 신속하게 진행할 예정"이라고 말했다.
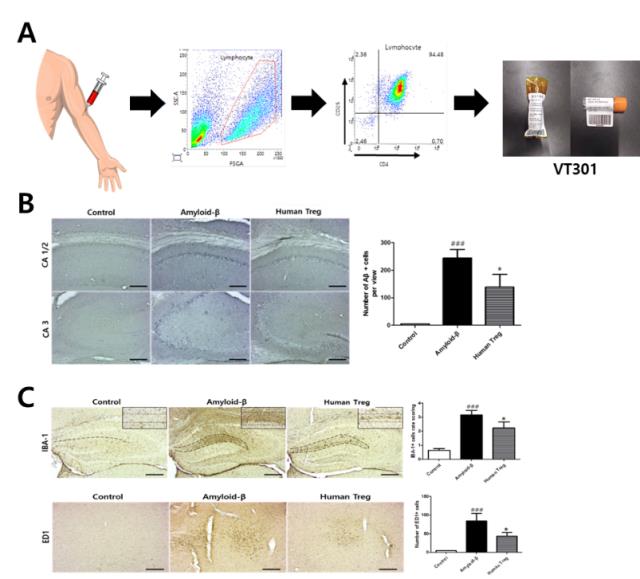
VT301은 치매를 일종의 면역질환으로 인식해 환자의 체내에 존재하는 조절 T세포를 외부에서 특정 조건으로 배양, 다시 이식하는 면역세포 치료제의 개념이다. 1~2종의 바이오마커(단백질 지표)만을 특정해 제거하는 방식의 치매 임상시험과는 차별된다.
㈜브이티바이오는 VT301의 미국 임상도 추진한다. 내년까지 미국 FDA 임상시험계획(IND)을 승인 받는 조건으로 '2020년 제1차 보건의료 R&D 비임상, 임상분야' 연구과제를 경희대 연구팀과 수행하고 있다. 이를 위해 글로벌 임상수탁업체(CRO) 코반스(COVANCE)와 계약을 맺고 GAP analysis(임상 갭 분석)을 진행한다. 이어 FDA 임상승인을 위한 전략을 구축하고 연말께 Pre-IND meeting(임상 사전미팅)을 진행한다는 방침이다.
㈜브이티바이오 관계자는 "기술이전(LO)을 목표로 오랫동안 임상을 준비했으며, 기술 방어를 위해 기등록된 특허 외 추가 국제 특허를 출원해 심사 중이다"면서 "브이티바이오 홈페이지에 이번 임상 승인에 대한 내용과 조절 T세포의 기전에 대한 동영상이 공개돼 있다"고 강조했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- 동인기연, 필리핀 바타안경제특구청과 협력 강화
- [i-point]태성, 임대공장 계약 "복합동박 장비 초도물량 대응"
- [상호관세 후폭풍]중국·베트남 생산비중 높은 HS효성, '고관세' 영향 불가피
- [중견 철강사 생존전략]동국산업, 손익 '엇박자'…영업흑자에도 순손실 300억
- [Red & Blue]무상감자에 관세 전쟁까지...'신저가' 찍은 KG모빌리티
- [석유화학 숨은 강자들]유니드, 고ROE와 상반된 PBR…중국공장 신설효과 기대
- [현대차그룹 벤더사 돋보기]에스엘 이사회 '오너 3세' 주축…'역할 분배' 뚜렷
- NH증권 점프업리그, 해외로 확장
- [중견 철강사 생존전략]KG스틸, 그룹내 '유동성 창출' 중심 부상
- KB국민은행, 가판대 대폭 조정…한·중 펀드에 힘























