[클리니컬 리포트]한독의 담도암 치료제, 글로벌 임상으로 승부수HD-B001A, 식약처에 임상 2/3상 IND 제출…2차 치료제 미충족수요 공략
홍숙 기자공개 2023-10-06 13:49:42
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2023년 10월 04일 16시21분 thebell에 표출된 기사입니다
한독이 담도암 치료제 개발을 위한 후기 임상에 재도전한다. 앞서 임상에 한 차례 제동이 걸렸지만 규제당국과 논의 끝에 국내 임상까지 진행한다는 계획이다. 이를 통해 미충적 의료수요가 큰 2차 치료제 개발에 도전한다.한독의 HD-B001A는 에이비엘바이오로부터 도입한 파이프라인이다. 현재 한국 임상은 한독이 진행하고 미국을 포함한 글로벌(중국 제외) 임상은 미국의 콤파스 테라퓨틱스(Compass Therapeutics) 주도로 이뤄지고 있다.
◇자진취하 2개월 만에 IND 재도전...콤파스 글로벌 임상에 한국이 참여하는 형태
한독은 지난달 26일 식품의약품안전처에 담도암 환자 대상 'HDB001A' 글로벌 2/3상 임상시험계획서(IND)를 제출했다. 지난 8월 IND 신청을 자진취하한 지 약 2개월만의 결정이다. 이번에 식약처로부터 IND 승인을 받으면 국내 임상은 콤파스 테라퓨틱스 주도로 이뤄지고 있는 글로벌 2/3상에 참여하는 형태로 진행된다.
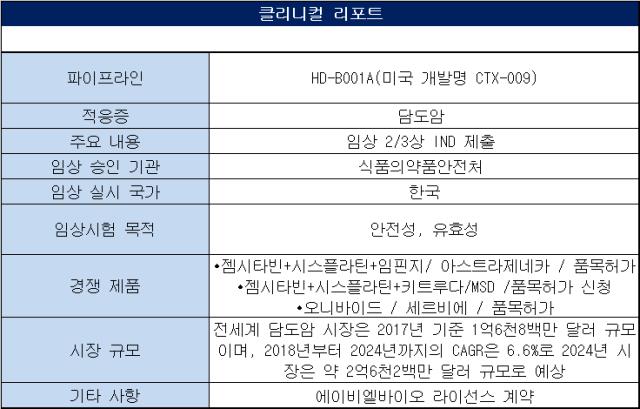
이번에 신청한 임상 설계는 지난번 취하한 것과 크게 다르지 않다. 회사 측은 8월 자진취하한 IND와 동일하며 '탐색적 임상시험'이라는 문구만 추가했다고 설명했다. 한독은 이번 임상을 통해 HDB001A의 유효성과 안전성 데이터를 확보하여, 이를 추후 허가 신청에 활용한다는 계획이다.
해당 임상은 세포분열을 막는 기전(세포독성항암제)의 파클리탁셀 단독요법 대비 이중항체 물질 HD-B001A(VEGF와 DLL4 동시 타깃)와 파클리탁셀의 병용요법을 비교·평가하는 형태로 설계됐다. HDB001A 글로벌 2/3상은 한국 및 해외 35여 개 기관에서 150명 환자를 대상으로 진행된다. 이전에 1회의 전신 항암화학요법을 받은 절제 불가능한 진행성·전이성 또는 재발성 담도암 성인 환자를 대상으로 한다.
앞서 콤파스 테라퓨틱스가 개발하는 CTX-009(HD-B001A과 동일)의 경우 동일한 디자인의 임상(2/3상)으로 이미 미국 식품의약국(FDA)로부터 IND 승인을 받았다. 올해 4월 미국에선 첫 환자 등록을 마치고 임상이 진행 중이다.
올해 1월 발표된 HDB001A 임상 2상에서 유효성을 평가한 결과에 따르면 HDB001A와 파클리탁셀을 병용투여한 환자 대상 객관적반응율(ORR)이 2차와 3차 치료에서 37.5%로 나타났다. 이와 함께 12개월 이상 추적 관찰 결과에서 무진행생존기간(mPFS)은 9.4개월, 전체생존기간(mOS)은 12.5개월로 확인됐다.
한독 관계자는 "HD-B001A의 미국 임상 2/3상은 이미 개시됐고 한독이 진행하는 한국 임상 2/3상에 대한 IND를 신청한 상황"이라며 "1차 치료제 개발 여부는 아직 결정되지 않았다"고 말했다.
◇미충족 의료수요 큰 담도암 2차 치료제 개발 도전
현재 담도암은 치료 옵션이 매우 제한적이다. 5년 생존율이 20%가 채 되지 않으며 10%만이 외과적 절제가 가능한 초기 단계에 발견되고 수술후에도 60%이상 높은 재발률을 보인다. 최근 1차 치료제로 면역항암제가 등장하며 2차 치료에서도 면역항암제가 처방이 늘고 있는 추세다.
특히 면역항암제 임핀지와 젬시스 병용요법을 시작으로 최근 면역항암제 키트루다 병용요법 역시 담도암 치료의 새로운 치료 옵션으로 각광받고 있다. 이와 함께 2차 치료제로 세포독성 항암제로 오니바이드가 활발히 처방되고 있는 상황이다. 하지만 아직 이들 신약들은 모두 비급여 약제다. 즉 2차 치료제로 처방 받으려면 환자들이 고가의 약가를 전액 부담해야 하는 상황이다.
이와 더불어 신약이 등장하고 있지만 아직까지 담도암 2차 글로벌 표준치료는 세포독성항암제인 폴폭스(FOLFOX) 요법이다. 현재 미국 종합 암 네트워크(National Comprehensive Cancer Network, NCCN) 가이드라인에서 진행성 담도암의 2차 치료로 폴폭스 요법을 권고하고 있다. 하지만 폴폭스 기반의 치료는 무진행생존기간(mPFS) 4.0개월, 전체생존율 6.2개월에 불과해 임상 현장에서는 한계가 있는 치료법으로 꼽힌다.
제약바이오 업계 관계자는 "현재 담도암 2차 치료제는 아직 뚜렷하게 임상적 유용성을 나타내는 신약이 없는 만큼 DLL4를 타깃으로 하는 한독의 개발 접근은 충분히 가능성이 있어 보인다"며 "다만 국내 상업화를 위해선 아직 2차 치료제의 면역항암제를 포함한 표적항암제도 모두 비급여인 만큼 빠른 개발 전략과 함께 보험급여 등재도 고려해야 할 것"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [i-point]오르비텍, 방사성폐기물 처리 신기술 도입
- 대우건설, 해외시장 진출 '박차'
- [Company Watch]온타이드, 매출절반 차지하는 해외법인 부진 지속
- [ESS 키 플레이어]한중엔시에스 '국내 유일 수랭식 공급' 가치 부각
- [크립토 컴퍼니 레이더]빗썸, 비언바운드 법인 청산…해외사업 '고배'
- [현대차그룹 벤더사 돋보기]에스엘, 투자 대폭 늘렸는데도 '무차입 기조' 유지
- [i-point]서진시스템 "베트남 대상 상호관세 부과 영향 제한적"
- [저축은행경영분석]굳건한 1위 SBI저축, 돋보인 '내실경영' 전략
- [보험사 자본확충 돋보기]iM라이프, 4달만에 후순위채 또 발행…힘에 부치는 자력 관리
- [저축은행경영분석]J트러스트 계열, 건전성 개선 속 아쉬운 '적자 성적표'























