[클리니컬 리포트]LG화학 통풍 신약 '티굴릭소스타트', 첫 3상 결과 '합격점'353명 대상으로 위약 대비 우수한 요산 수치 감소 확인
정새임 기자공개 2024-11-15 14:27:27
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2024년 11월 15일 07:57 thebell 에 표출된 기사입니다.
LG화학이 약 2년간 진행해온 통풍 신약이 글로벌 3상 임상시험에서 첫 효능을 입증했다. 10조원 규모에 달하는 통풍 치료제 시장에서 '계열 내 최초(Best-in-class)'를 꾀한다는 목표에 한층 가까워졌다.LG화학은 14일 통풍 치료 신약 '티굴릭소스타트'의 글로벌 3상 임상시험 톱라인 결과를 공시했다. 2022년 9월 미국 식품의약국(FDA)으로부터 3상 임상을 승인받은 후 2년간 전 세계 4개국 55개 기관에서 진행한 임상이다.
티굴리소스타트 3상은 EURELIA 1과 2로 나누어 진행된다. 이번에 발표된 첫 3상 데이터는 EURELIA-1 임상이다.
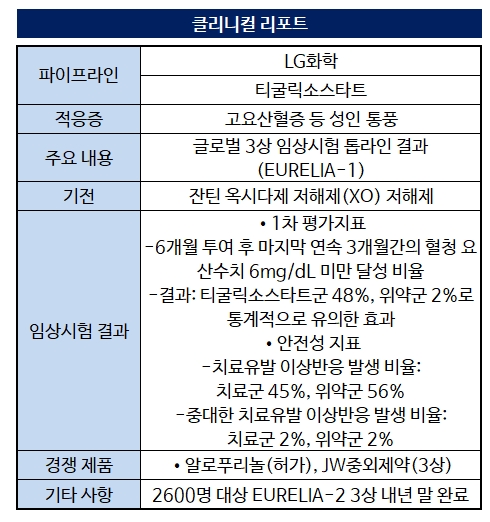
임상은 고요산혈증을 동반한 통풍 환자 353명을 대상으로 했다. 1차평가변수로 티굴릭소스타트 6개월 투여 후 마지막 연속 3개월간의 혈청 요산 수치를 체크해 6mg/dL 미만을 달성한 대상자 비율을 위약과 비교했다.
그 결과 티굴릭소스타트 투여군에서는 평균 48% 환자가 6mg/dL 미만을 달성해 위약군 2% 대비 통계적으로 유의한 효과를 기록했다. 안전성도 합격점을 받았다. 치료유발 이상반응 발생 비율은 치료군 45%, 위약군 56%로 위약군이 오히려 더 높았다.
부작용은 경증 또는 중등증이 대부분이었다. 중대한 치료유발 이상반응 역시 치료군과 위약군 모두 2% 정도로 차이가 없었다. 모든 군에서 보고된 사망사례는 없었다.
EURELIA-2 연구는 2600명 대규모 환자를 대상으로 한다. EURELIA-1 임상과 같이 1차 유효성평가를 6개월 투여 기준으로 삼지만 최대 12개월까지 치료 효과를 살핀다.
또 위약이 아닌 통풍 치료에 주로 쓰이는 기존약 '알로푸리놀'과 비교함으로써 난이도를 높였다. 티굴릭소스타트 용량에 따라 3개군으로 나누고 기존약 투여군, 위약군 총 5개군으로 평가하고자 했다.
티굴릭소스타트는 잔틴 옥시다제(OX) 발현을 억제하는 기전의 비퓨린계 약물이다. 2상 결과 기존 치료제의 효능을 개선할 가능성이 높은 것으로 나타나 기대감을 높였다.
350여명을 대상으로 한 첫 3상에서도 우수한 효능을 입증하며 신약 허가 가능성을 높였다. LG화학은 EURELIA-2 3상 결과까지 확인한 후 신약 허가 절차를 밟을 전망이다. EURELIA-2 임상은 내년 말 완료를 목표로 한다.
LG화학 관계자는 "미국과 유럽 등 글로벌을 대상으로 EURELIA-2 3상을 진행 중이며 해당 임상 결과를 내년 말 마무리할 계획"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- [i-point]폴라리스오피스, 'CES 2025' 혁신상 "토종 오피스 최초"
- [i-point]흑자 전환 성공한 콤텍시스템, 별도 매출 최대치 달성
- [Company Watch]덕산네오룩스, OLED 전환 효과 '톡톡'
- [i-point]쌍용정보통신, 3분기 영업익 95억…실적 개선 성공
- [i-point]아이티센, 3분기 누적 매출 역대 최고치 3조4554억
- [Company Watch]디이엔티, '캐즘'에도 레이저 노칭 수요 확대
- [Company Watch]'실적 호조' 지니언스, 최고 매출 '알짜 실적'
- [Company Watch]플래티어, 3분기 매출 성장세…적자 해결 '아직'
- [i-point]에스넷시스템, 3분기 매출 1105억…전분기 대비 7.8% 증가
- [클리니컬 리포트]LG화학 통풍 신약 '티굴릭소스타트', 첫 3상 결과 '합격점'
정새임 기자의 다른 기사 보기
-
- [thebell note]암 정복을 위한 'K-바이오'의 도전
- [클리니컬 리포트]LG화학 통풍 신약 '티굴릭소스타트', 첫 3상 결과 '합격점'
- 콜린제제 포기하는 제일약품, 든든한 '자큐보'의 존재
- 피씨엘 특수관계 정리한 2대주주 올릭스, 잇단 주식 매도
- 동아에스티서 짐싸는 '정통 동아맨', 굳건한 '변화 의지'
- 미국 제3의 바이오허브에서 열린 'K-바이오' 교류의 장
- 다원메닥스, 상장 자진철회…배경은 '매출', 시장성 입증 총력
- [폐암 신약 새 판 짜는 제이인츠바이오]조안나 대표 "신약개발도 비용 효율화, 빠른 자생력 필요"
- '코스닥 상장' 눈앞에 둔 듀켐바이오, 10주만에 예심 승인
- '오버행' 직격탄 맞은 토모큐브, 상장 첫날 주가 -37%

























