코아스템켐온, 루게릭 3상 1차지표 고배 '토퍼센 트랙' 고심 유효성 입증 안 돼, 바이오마커 추가 분석…바이오젠 사례 벤치마크
이기욱 기자공개 2024-12-20 08:17:24
이 기사는 2024년 12월 19일 07:15 thebell 에 표출된 기사입니다.
코아스템켐온의 루게릭병 치료제 임상 3상에서 1차 데이터의 유효성을 입증하지 못했다. 3상 결과가 식품의약품안전처의 조건부 허가에도 영향을 미칠 수 있는 만큼 신규 생산 공장 활용 방안 등에도 차질이 불가피해질 전망이다.코아스템켐온은 아직 1차 데이터에 불과하기 때문에 3상 실패를 단정 짓기는 시기상조라는 입장이다. 내년 1분기까지 하위 분석에 집중할 예정이다.
바이오마커 데이터를 기반으로 판매가 이뤄진 미국 바이오젠의 '토퍼센'과 같은 절차를 추진하는 등 다양한 돌파구를 마련해 나갈 방침이다.
◇데이터 발표 후 주가 30% 하락…핵심 파이프라인 타격 불가피
코아스템켐온은 최근 공시를 통해 근위축성측삭경화증(루게릭병) 치료제 '뉴로나타-알주'의 임상 3상 시험 결과 톱라인(Topline) 결과를 수령했다고 밝혔다. 톱라인은 각 임상에서 허가당국에 제출한 각 평가기준에 대한 결과의 요약을 의미한다. 후보물질의 효능과 안전성을 평가하는 데이터로 임상의 최종 성패를 가늠할 수 있는 지표다.
뉴로나타-알주의 임상 3상은 한양대학교병원 외 국내 4개 병원에서 총 125명을 대상으로 진행됐다. 이번 톱라인 데이터는 투약 후 6개월과 12개월 시점의 Joint rank score(기능 및 생존 기간 통합분석)를 비교한 1차 데이터다.
1차 데이터 분석 결과 시험약을 투약한 시험군1은 투약 후 6개월 시점과 12개월 시점 모두에서 대조약을 투약한 시험군2와 유의미한 차이를 보이지 않았다. 신약으로서의 유효성을 입증하지 못한 것이다.
'뉴로나타-알주'는 코아스템켐온의 파이프라인 중 개발 단계가 가장 앞서 있는 핵심 사업이다. 2013년 5월 1/2상 임상을 완료한 후 이듬해 희귀의약품에 지정되며 식약처 조건부 허가를 승인 받았다. 2014년 7월부터 현재까지 국내 시판이 이뤄지고 있다.
식약처의 조건부 허가는 중대질환 치료제 및 희귀의약품에 한해 추후 3상 자료 제출을 전제로 임상 2상 후 판매를 승인해주는 제도다. 흔한 경우는 아니지만 현재 판매가 이뤄지고 있는 제품이라도 원칙적으로 3상 결과에 따라 조건부 허가가 취소될 수 있다.
때문에 뉴로나타-알주의 1차 데이터 결과는 곧장 큰 충격으로 다가왔다. 17일 종가 기준 1만4750원이었던 코아스템켐온의 주가는 18일 29.97% 하락한 1만330원으로 하락했다.
◇매출 비중 3.4%로 높지 않아…제조소도 CDMO로 활용 가능
코아스템켐온 측은 이번 데이터를 두고 임상 3상 실패를 단언하기에는 이르다는 입장이다. 내년 3월쯤 최종 임상시험결과보고서(CSR)를 수령한 후 임상 3상 시험 결과를 추가로 공시할 계획이다. 1차 데이터 외 하위분석을 지속 진행할 방침이다.
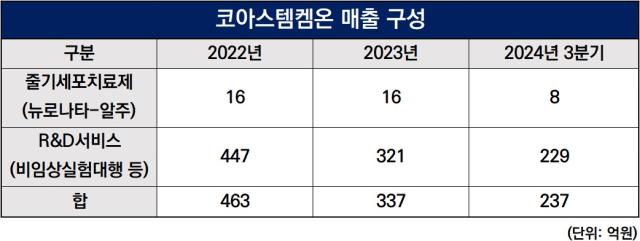
유일한 판매 제품이긴 하지만 전체 매출에서 차지하는 비중이 그리 큰 편은 아니다. 3분기 기준 8억원으로 전체 매출 237억원 대비 3.4% 수준에 불과하다. 비임상실험 대행 용역 부문에서 나머지 229억원의 매출이 발생했다.
최근 완공된 청주 세포치료제 제조소 역시 CDMO(위탁개발생산) 등 다른 방향으로 활용 가능할 것으로 예상된다. 코아스템켐온은 작년부터 올해까지 총 191억원을 들여 세포치료제 제조소를 설립한 바 있다.
미국 바이오젠의 '토퍼센'과 같은 특수한 절차를 통한 판매 가능성도 거론된다. 코아스템켐온의 이번 임상은 2020년 미국 식품의약국(FDA) 승인 이후 한국·미국 동시 임상으로 진행됐다.
바이오젠의 루게릭병 치료제 토퍼센 역시 임상 단계에서 환자의 질병 진행을 늦추는데 실패했다. 하지만 그 과정에서 신경 손상 바이오마커(생물지표)인 신경섬유의 경쇄(NfL) 수준을 낮추는 데 성공했다.
이에 FDA 자문단은 NfL 감소 효과를 토대로 해당 치료제가 환자들에게 도움이 될 가능성이 높다고 판단했고 토퍼센은 임상 실패에도 불구하고 작년 신약 허가를 받았다.
코아스템켐온 관계자는 "1차 데이터에서 유의미한 값을 확인하기 힘들었지만 앞으로 추가 분석이 이뤄질 것"이라며 "아직 임상 결과가 최종적으로 확정된 것은 아니기 때문에 그 이후를 얘기하기는 시기상조"라고 말했다.
이어 "미국 시장 시판 허가 등 다양한 가능성을 열어 놓고 내부 논의를 진행할 것"이라고 밝혔다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- 유니클로 살린 정현석, 아울렛 경쟁력 강화 '뉴 미션'
- 한세예스24홀딩스, 이래AMS 출자로 재무 부담 '경감'
- 아모레퍼시픽, 라네즈 '글로벌 성장' 전략 가속화
- [밸류업 프로그램 리뷰]AK홀딩스, 'ROE 10%' 달성 방안은
- 롯데쇼핑, '인천 개발사업' 자회사 합병 배경은
- '공무원' 떼내는 메가스터디교육, 재무 영향은
- 교촌F&B, 첫 무상증자 배경 '실적 자신감'
- BGF리테일, '지주 전략가 수혈' 본업 체질개선 집중
- 한샘, '고객관리' 자회사 대표에 전략기획실장 배치
- [대상웰라이프는 지금]미뤄진 '중국 합작법인' 설립, K-건기식 돌파구는
이기욱 기자의 다른 기사 보기
-
- [2024 이사회 평가]'구성원 5명' 환인제약, 경영성과로 외형 약점 만회
- 동화약품, 작년 재무발탁…올해는 실적좋은 OTC 보상인사
- 코아스템켐온, 루게릭 3상 1차지표 고배 '토퍼센 트랙' 고심
- [동방메디컬 IPO In-depth]맨파워가 경쟁력, 영업·플랜트 전문가로 기업가치 제고
- 삼성바이오로직스, '존림 체제' 유지에도 드러난 변화의지
- 동국제약, 포트폴리오 다변화 효과 벌크업…수익성 개선도
- 아리바이오, 치매신약만 있다? '저주파 기기' 가능성 확인
- 삼성바이오로직스, 10년만에 CFO 교체…전자출신 '유승호'
- 위기의 롯데, 의외의 확장 계열사 '의료'…보바스병원 주목
- 제테마 '더톡신주' 국내 허가, 이르면 내년 3월 시판





















