[미지의 시장 '치매' 개화 길목에 서다]이단아일까 기린아일까, 아리바이오의 글로벌 3상 도전기①비항암제 분야로 첫 사례…1000억대 업프론트 기술이전, 1250명 다국가임상 지탱
최은수 기자공개 2024-07-30 09:28:49
[편집자주]
인류 건강 최대 난제인 치매. 일라이릴리가 3번째 알츠하이머병 치료제 키썬라를 상업화 하면서 다시 한번 치매 시장에 대한 관심이 급부상하고 있다. 알츠하이머병으로 대표되는 치매 치료 '옵션'이 만들어졌지만 여전히 미지의 영역, 미완의 과제다. 더 많은 기업들의 공조 그리고 경쟁이 필요하다. 근본 치료 외 예방과 사후관리 등 시장의 '판'을 깨는 옵션도 눈여겨 볼 지점이다. 혁신신약 개발 기대주부터 진단과 사후 관리를 포함한 '치매 치료 전주기'를 노리는 기업들까지 더벨이 치매 시장을 들여다봤다.
이 기사는 2024년 07월 29일 08:36 thebell 에 표출된 기사입니다.
한국 바이오텍이 글로벌 임상 3상을 진행한다는 건 쉬운 일이 아니다. 더구나 그 영역이 중추신경계질환(CNS)이라면 더더욱 어려운 길이다. 그런 관점에서 아리바이오가 알츠하이머병 치료제 'AR1001'을 통해 글로벌 3상을 하고 있다는 점은 이례적이라고 볼 수 있다.그러나 시장의 전반적인 평가는 예상보다 박하다. 남들이 가지 않은 길을 간다는데 대한 의구심이 앞선다. 이에 더해 사업전환(피보팅)과 저조한 기술성평가 결과라는 환경적인 배경도 있다.
업계의 백안시를 걷어내면 이야기는 달라진다. 먼저 국내에서 알츠하이머병 다국가임상(MRCT)의 길을 처음 열었고 1250명을 대상으로 하는 대규모 임상도 예고했다. 사업 전략으로 3상에서의 라이선스 아웃(L/O)을 택한 것도 의미있는 한수였다. 국내에선 '비항암제' 계열 3상 물질 중에서 업프론트가 1000억원을 넘은 첫 사례를 만들었다.
◇약물재창출서 비롯된 평가절하 뚫고 'MRCT 막바지'
2010년 설립된 아리바이오는 초창기에는 화장품·건기식에 집중했다. 그러나 이후 사업전환에 나서며 퇴행성뇌질환 파이프라인 5개를 확보했다. 핵심 파이프라인 AR1001, 타우 병변 알츠하이머병, 레트 증후군 치료제인 AR1002, 복합제인 AR1003, 천연물인 AR1004, 루이소체 치매를 타깃하는 AR1005 등이다.
그 중 핵심파이프라인은 AR1001이다. 발기부전 치료로 쓰이던 저분자화합물 PDE-5 억제제 미로데나필의 약물재창출(Drug Repositioning)을 통한 도전이다.
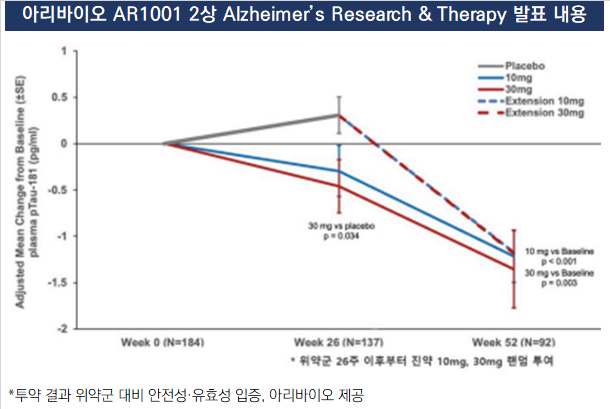
국내서는 사실 '약물재창출'이라는 프로젝트 자체로 평가절하를 한다. 이 같은 시장의 부정적인 인식은 기술성평가에도 영향을 줬다.
아리바이오는 2022년 기술성평가 도전 당시 국내 기업 중 처음으로 알츠하이머병 MRCT 프로그램을 가동해 2상을 마쳤다. 그럼에도 2018년에 이어 기술성평가 문턱을 넘지 못하며 분루를 삼켰다. 국내선 알츠하이머병 치료제 개발과 관련해 비슷한 성과를 낸 곳조차 보이지 않은 걸 고려하면 아쉬운 결과였다.
당시 AR1001의 임상 2상 유효성 안전성 최종 데이터(PE)는 SCIE급 학술지에 실리기도 했다. 시장이 아직 알츠하이머병, 즉 치매 치료제 개발에 대한 이해가 높지 않았던 것도 영향을 준 것으로 풀이된다.
약물재창출이라고 하지만 AR1001의 기전은 알츠하이머 학계서 상당한 관심을 둔 영역이다. 세부적으로 PDE-5 억제(inhibitor)를 통한 크렙(CREB)·윈트(Wnt) 그리고 자가포식(Autophagy) 활성화를 이끄는 다중기전이다. 앞서 레켐비와 키썬라가 아밀로이드베타 단백질을 타깃해 알츠하이머성 치매를 넘어서려는 것과 또 다른 접근법이다.
◇R&D 비용 두고 '설왕설래' 2상까지 500억 지출, 3상 위해 2000억 확충
업계에선 임상 3상에 들어선 아리바이오의 그간 R&D 비용 지출 추계가 지나치게 낮다는 점도 의구심 혹은 비판의 대상에 올린다. 아리바이오는 2019년 이후 임상 3상에 들어서기까지 총 500억원의 R&D 비용을 지출했다. 2상을 마치고 3상이 본격화되기 전임을 고려하면 많지도 적지도 않은 '통상 범주'에 있다.
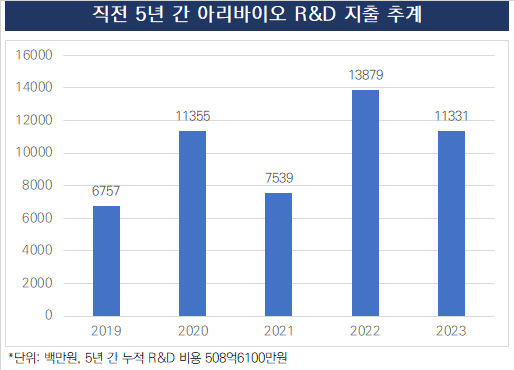
같은 저분자화합물 물질 타입으로 글로벌 위암·간암 3상을 마친 HLB의 5년간 지출 추계가 2000억원이 넘는 점과는 대조를 이룬다. 그러나 아리바이오는 이제 3상 초입이며 말기암 환자가 아니라 '초기 알츠하이머병 환자'를 대상으로 임상을 진행하는 점이 업계의 R&D 비용 통념과 격차가 나는 원인으로 꼽는다.
통상 항암신약 임상에선 표준치료를 포함해 여러 차례의 약물 처방에도 상태가 나아지지 않은 극한 상태에 있어 여러 전후 처치가 필요한 환자를 모집한다. 반면 아리바이오는 '알츠하이머 전조증상(prodromal·prodromal-Mild)'에 해당하는 환자군을 타깃한다. 더불어 레켐비나 키썬라와 달리 '경구제'로 개발 중인 점도 고려할 필요가 있다.
아리바이오가 이제 막 3상 소화를 시작한 것도 앞서 R&D 비용 추계를 이해하기 위한 실마리다. 통상 임상 2상 대비 3상은 '규모'가 달라지면서 임상 기간이나 비용 지출 추이가 몇 배 이상 뛴다.
세부적으로 아리바이오가 3상에서 예정한 모집환자는 1250명이다. 국내에서 150명을 모집하고 미국서 약 600명, 중국에선 100명, 영국을 포함한 유럽연합 7개국에선 약 400명의 환자를 모은다. 아리바이오가 5년 간 R&D 비용 500억원 중 상당부분을 할애해 유효성과 안전성을 확인한 2상에서 모집한 환자는 총 210명이었다.
아리바이오는 국내 비항암제 개발 기업 중 처음으로 3상 물질로 계약총액 1조200억원의 딜을 만들고 1200억원의 L/O 업프론트를 받는다. 그럼에도 올해 초 시장에서 추가 펀딩을 단행했다. 이 역시 MRCT를 위한 '임상자금 확충'으로 설명이 된다.
업프론트가 유입되기 전인 올해 1분기 말 기준 아리바이오의 유동성은 800억원이다. 이를 종합하면 현재까지 막바지 임상인 3상에 대비하기 위한 통상적인 절차를 밟은 것으로 확인된다. 항암 대비 비용 부담이 적다고 해도 R&D 완주를 위해 부단히 노력한 결과 이제는 임상 중 재무 체력 고갈에 대한 우려를 상당 부분 덜어낸 것으로 보인다.
아리바이오 관계자는 "글래스고대학교 이학박사, 케임브릿지 대학교 생명공학연구소 출신의 정재준 대표를 구심점으로 R&D를 진행 중"이라며 "업프론트로 글로벌 R&D 동력을 얻어 내년 말 임상을 마무리하는 게 목표"라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- '싸움의 고수' 김앤장
- [thebell desk]한미의 오너, 한미의 대주주
- 한국투자증권, 영업익 1위 '순항'...투자·차입 규모 조절
- [IB수수료 점검]SK증권, '자본잠식' 큐로홀딩스 유증 딜 수수료 '최대'
- [Company & IB]SK브로드밴드·한국증권, 장기물 흥행 '의기투합'
- [IPO 모니터]'자진 철회' 에이스엔지니어링, 상장 행선지 바꾸나
- [동인기연은 지금]'공들인' 자체 브랜드, 상장 이후 성장세 '멈췄다'
- 자회사 수혈 '숨가쁜' JB지주, 막바지 조달 나선 배경은
- 더랜드, 더팰리스73 'EOD' 3개월째…사업 운명 기로
- [새판 짜는 항공업계]다크호스 이스타항공, 항공업 판도 바꿀까
최은수 기자의 다른 기사 보기
-
- [Board change]합병 앞둔 한화인더스트리, '비전 C레벨' 이사회 합류
- [캐시플로 모니터]한화오션, 2조 유증에도 아쉬운 현금흐름 '또 차입'
- DB금투, '약식명령'에 저축은행 대주주 적격성 흔들
- [CFO 인사 코드]'변화대신 안정' 미래에셋그룹, 재무라인 교체 '없었다'
- [On the move]'그룹 넥스트' 찾는 삼성물산, '신사업 팔방미인' 공채
- 명륜진사갈비의 '변신을 위한 용기'
- [2024 이사회 평가]'AI 투자회사 변신' SK네트웍스, 힘 보태는 이사회
- [2024 이사회 평가]'사내이사 없는 이사회 고수' 한샘, 참여도만 '우수'
- [조달전략 분석]포스코홀딩스, 급전 융통 창구된 '해외 계열사 지분'
- [Board change]'보험 키맨' 필요했던 롯데손보, 금감원 출신 영입
























