[K-바이오 'ADC' 리포트]'엔허투' 빈틈 파고든 인투셀, 내년 본임상 '검증의 시간'②링커-페이로드 등 플랫폼 3종 우수성 강조, ITC6146RO 물질 데이터 '관건'
김진호 기자공개 2024-12-02 09:59:05
[편집자주]
항체약물접합체(ADC)를 겨냥한 K-바이오에 대한 시장 주목도가 높다. '엔허투'를 기점으로 폭발적으로 관심이 높아진 글로벌 ADC 시장에서 기술력으로 중무장한 국내 바이오텍들이 '기술이전' 딜 등을 통해 가능성을 입증하고 있다. 빅파마와의 딜을 체결한 리가켐바이오를 비롯해 국내 바이오 맏형격인 셀트리온과 삼성바이오로직스까지 저마다 각자의 방식대로 전략적 투자 및 협업으로 역량을 키우고 있다. 더벨은 ADC로 향하는 열차에 탑승한 K-바이오의 전략을 차례로 조명한다.
이 기사는 2024년 11월 29일 13:04 thebell 에 표출된 기사입니다.
ADC 모달리티를 블록버스터급 반열에 올려놓은 치료제 엔허투. 가장 성공한 약물로 꼽히지만 부작용 면에선 해결해야 할 과제를 남겼다. 엔허투는 이 지점을 파고들며 엔허투의 부작용을 극복하는데 집중하고 있다. 더 나은 링커와 신규 페이로드로 부작용 개선을 데이터로 입증한다.신규 페이로드 '넥사테칸'을 엔허투의 페이로드와 맞바꾼 결과 독성이 크게 떨어진 데이터를 얻었다. 정상세포에서 약물을 단단히 붙잡는 링커 플랫폼 '오파스(OHPAS)'와 페이로드의 세포막 결합 특성을 줄이는 ‘페이로드 변형 플랫폼(PMT)'까지 융합하면 ADC의 효능도 더 끌어올릴 수 있다는 분석이다.
이제는 임상을 통해 플랫폼의 가능성을 검증하는 일이 남았다. 내년 중 선도물질 'ITC6146RO'의 임상 진입을 목표로 하고 있다. 인투셀의 밸류에이션을 가를 주사위가 던져졌다.
◇신규 페이로드 ‘넥사테칸’, 엔허투 부작용 극복 가능
ADC는 항체와 링커, 페이로드를 이어붙인 항암 모달리티다. ADC가 일반 항체치료제 대비 월등한 효능을 보이지만 전달 효율이나 부작용 측면에서 극복해야 할 기술적 과제도 산적해 있다. 암세포로 더 잘 전달되면서 정상세포는 덜 공격하는 링커와 페이로드 연계 플랫폼 확보가 최근 ADC 개발의 화두인 이유다.
인투셀은 2015년 설립 직후부터 항체를 제외한 ADC 구성 요소별 차세대 플랫폼 확보에 주력했다. 그 결과 넥사테칸과 오파스, PMT 등으로 명명된 플랫폼을 완성했다.
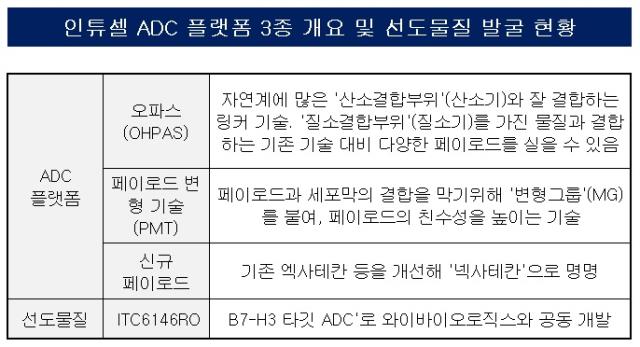
우선 넥사테칸은 페이로드다. 엔허투에 쓰인 토포아이소모레이즈(국소이성질화효소) 억제제 계열의 페이로드는 화학항암제로 쓰이는 약물로 독성과 내성 발생 가능성이 높다.
넥사테칸은 토포아이소모레이즈보다 독성이 낮은 엑사테칸이라는 물질을 다시 한번 최적화해 만든 페이로드다. 30여 개 후보물질 중 넥사테칸3(NxT3)가 가장 효능이 좋아 이를 ADC에 접목하고 있다.
인투셀은 엔허투와 같은 항체와 링커에 페이로드만 넥사테칸3로 교체한 다음 성능을 비교했다. 엔허투는 ㎏당 78.8㎎의 용량으로 투여할 때 심각한 부작용이 일어났지만 넥사테칸3를 붙인 ADC는 비슷한 용량을 넣어도 문제가 발생하지 않았다.
◇링커 및 페이로드 변형기술도 보유…ADC 효능 향상 기대
시판된 ADC를 체내에 투약하면 약 1% 이하만 암세포에 도달하는 것으로 확인되고 있다. 효능 저하와 부작용 문제가 페이로드만 바꾼다고 해결되지 않는 이유다.
엔허투 임상 3상에서도 총 257명의 환자 중 약 43%인 110명에서 호중구감소증이 관찰됐다. 이 중 49명은 그레이드(GRADE)3에 해당하는 중증 등급으로 부작용이 나타났다. 혈중에서 잘못 풀린 링커에서 떨어져 나온 페이로드가 혈중에 있는 호중구 전구세포를 공격하면서 그 수를 크게 떨어뜨린 것으로 해석됐다.
정상세포가 아닌 암세포 주변에서만 링커가 풀리도록 만드는 기술이 연구됐다. 이를 위해 인투셀이 고안한 플랫폼이 오파스다.
오파스는 페이로드나 항체와 연결된 링커의 화학 반응을 다루는 기술이다. 이 중 페이로드와 연결되는 부위의 화학반응을 ‘Cleavage chemisty'라고 한다. 이 반응이 제대로 일어나야 페이로드가 필요한 부위에서 확산될 수 있다. △시젠이 가진 VC-PABC 기술 △시애틀 제네틱스의 이황화물 연결 기술 △이뮤노젠의 베타-글루코로나이드 기술 등이 대표적이다.
기존 기술은 화학구조상 '질소 결합 부위(질소기)'를 가진 페이로드와 잘 결합한다. 하지만 자연계에는 '산소 결합 부위(산소기)'를 가진 페이로드가 더 많다. 오파스는 산소기와 잘 결합하도록 구조를 설계한 플랫폼이다.
인투셀은 오파스와 넥사테칸3의 장점을 살릴 수 있는 PMT도 확보했다. 시판된 ADC에 들어간 페이로드는 소수성을 보이기 때문에 같은 성질을 띤 세포막과 반응해 정상세포로 들어갈 확률이 다소 높았다. PMT는 친수성으로 바꿔주는 변형그룹(MG)을 추가해 ADC의 페이로드가 세포막과 상호작용하는 비율을 줄인다.
결국 3종의 플랫폼을 연계해 개발한 ADC는 암세포에 도달하는 비율이 높아질 것이란 관측이다. 효능 증대를 기대할 수 있다는 얘기다.
유요섭 인투셀 최고기술책임자(CTO)는 “우리 플랫폼을 쓰면 암세포로 전달되는 비율이 높아진다”며 “드라마틱하게 높아지는 것은 아니지만 현재 1% 수준에서 2%만 되도 효능이나 부작용면에서 큰 이점을 가져갈 수 있다”고 말했다.
◇플랫폼 검증위한 첫 발, 내년 첫 임상 진입 목표
이제 남은 건 최종 검증 작업이다. 인투셀이 보유한 선도물질 'ITC6146RO'의 임상을 통해 자사 플랫폼의 안정성과 효능을 입증한다는 계획이다.
이 물질은 넥사테칸을 발굴하기 전 임상 시도를 목적으로 설계됐다. 오파스와 PMT 플랫폼을 바탕으로 B7-H3 타깃 항체에 페이로드로는 널리 쓰는 듀카마이신을 일부 개량해 접합시켰다.
여기에 접목하는 항체는 2017년 와이바오로직스와 공동연구 계약을 맺으며 확보했다. 일부 고형암 표면에 존재하는 'B7-H3' 항원 타깃용이다.
해당 물질의 발굴 및 비임상 연구가 국가신약개발재단의 과제로 세 차례 선정되기도 하며 주목받았다. 해당 과제들의 총 사업규모는 약 60억원에 이른다. 인투셀은 내년 ITC6146RO의 임상 1상 진입을 위한 막바지 준비 절차를 밟고 있다.
ITC6146RO와 같은 항원을 타깃하는 경쟁 약물도 있다. 다이이찌산쿄의 DS-7300a와 마크로제닉스의 MGC018 등이 이미 임상 2상을 진행 중이다.
DS-7300a는 독성이 약한 엑사테칸을 페이로드로 사용했지만 약물에 비특이적으로 결합해 제어력이 떨어지는 초기 링커가 적용됐다. 또 MGC018 역시 5월 임상에서 사망자가 보고되는 등 기술적 측면에서 문제점이 부각되고 있다.
문성주 인투셀 최고과학책임자(CSO) "자사 플랫폼의 경쟁력은 세계적으로 봐도 떨어지지 않는다"며 "임상 진입에 성공한 다음 그 우수성을 검증해 나가겠다"고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- [i-point]한컴위드, 한컴 지분 추가 매입…그룹 지배구조 강화
- [i-point]정철 브이티 대표, 블록딜로 개인채무 상환 매듭
- 셀비온 'Lu-177-DGUL' 환자늘어도 ORR 개선, 상업화 기대
- [2024 이사회 평가] 가온칩스, 눈부신 경영성과…이사회 전반 과제 '산적'
- LB세미콘, DB하이텍 전력반도체 개발 협업
- [Company Watch]덕산테코피아, 일렉테라 수직계열화 구축 '한파 극복'
- [K-바이오 'ADC' 리포트]신경외과 교수가 본 가능성, 3요소 다 갖춘 에임드바이오
- [코스닥 상장사 매물 분석]알파홀딩스 인수나선 엔스넷, 인수 후 매각 전문 이력 '눈길'
- [온코크로스 IPO In-depth]플랫폼 기업 피보팅, 글로벌 확장 위한 핵심 전략 'BD'
- '재무·R&D' 힘준 HLB 인사, 넥스트 리보세라닙 전열 정비
김진호 기자의 다른 기사 보기
-
- [K-바이오 'ADC' 리포트]신경외과 교수가 본 가능성, 3요소 다 갖춘 에임드바이오
- [K-바이오 'ADC' 리포트]'엔허투' 빈틈 파고든 인투셀, 내년 본임상 '검증의 시간'
- [K-바이오 'ADC' 리포트]리가켐, 링커에 페이로드까지 '신약' 변곡점 'LCB39 본임상'
- UMass도 아이빔테크 장비쓴다, 높아진 '글로벌 인지도'
- 씨젠, IT 역량 확보에 진심 M&A 이어 채용까지 'B2B' 강화
- [K-바이오 'ADC' 리포트]데이터로 만든 '항암치료'의 대세, '효능·독성' 미완의 시장
- [루키 바이오텍 in market]뉴라클사이언스, 난청 1상 연내 결과 '상장 재시동' 분기점
- [2024 이사회 평가]셀트리온제약, 이사회 전반적 '열위'…'견제·접근성' 미흡
- 이오플로우, 인슐렛 제기 'EU 판매금지' 소송 결론 도출
- [제약바이오 현장 in]제놀루션 "침체기 끝났다, 주력 3개 사업 2025년 변곡점"





















