대웅제약, 더뎠던 中 폐섬유증 신약 반환 '시장성' 타격 CS파마 임상 2상 결과 못낸 상태서 반환, 공동 개발 통한 신규 적응증 발굴 예정
김혜선 기자공개 2025-03-31 08:33:27
이 기사는 2025년 03월 28일 16시58분 thebell에 표출된 기사입니다
대웅제약의 유일한 기술이전(L/O) 신약 물질이었던 '베르시포로신'이 반환 통보를 받았다. 중국 CS파마슈티컬즈(이하 CS파마)를 통해 중화권에 진출하려던 계획을 전면 수정하게 됐다.베르시포로신은 '계열 내 최초(First-in-class)'로 개발 성공 시 높은 시장성이 기대됐다. 하지만 약 2년간 CS파마가 베르시포로신 개발을 거의 진행하지 않은 탓에 신약 가치가 하락할 우려를 안게 됐다. 대웅제약은 중화권 진출 전략을 재설정하는 동시에 한국과 글로벌 개발을 이어가는 중이다.
◇베르시포로신 기술이전 해지 의향 통보, 2년간 개발 지연
대웅제약은 28일 중국 CS파마로부터 베르시포로신(중국 개발명 CSP-088)'에 대한 기술이전 계약에 대한 해지 의향 통보를 받았다고 공시했다. CS파마의 폐섬유증 등 연구개발 전략 변경에 따른 기술이전 계약 해지라는 게 회사 측 설명이다.
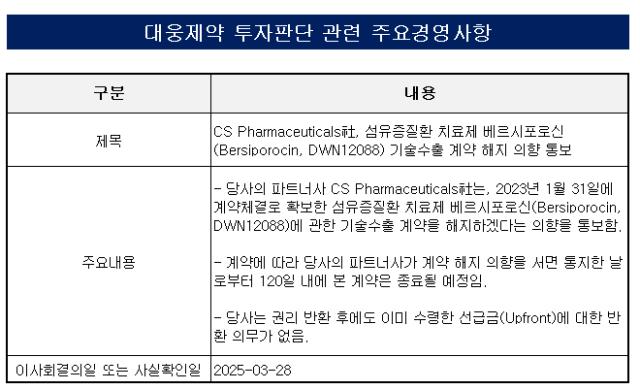
베르시포로신은 대웅제약이 계열 내 최초 신약으로 개발 중인 특발성 폐섬유증(IPF) 치료제 후보물질이다. 미국 식품의약국(FDA)로부터 희귀의약품 및 신약심사제도 개발 품목으로 지정받고 글로벌 임상 2상을 진행 중이다.
2022년 7월 국내 제약사 중에서는 최초로 미국 식품의약국(FDA) 패스트트랙 지정을 받을 정도로 유망 물질로 꼽혔다. 패스트트랙으로 지정받으면 개발 단계부터 FDA 심사팀과 임상시험 설계 논의, 허가에 필요한 안전성 자료 범위 등을 긴밀히 논의해 허가 가능성을 높일 수 있다.
2023년 1월 CS파마와 기술이전 계약을 맺으면서 중화권 진출 길이 열렸다. CS파마가 중국 내 개발 권리와 중국·홍콩·대만·마카오 등 중화권에 대한 상업화 권리를 확보하는 내용이다. 그 조건으로 선급금 약 74억원(600만달러)와 개발에 따른 마일스톤으로 총 약 934억원(7600만달러)을 지급한다. 이 외 상업화 시매출에 따른 로열티가 있다. 총 계약규모는 4130억원(3억3600만달러)이다.
반환 의무가 없는 선급금은 총계약금액의 2%에 불과해 상대적으로 적은 편이었다. 개발이 지속됐더라면 개발에 따른 마일스톤을 수령할 수 있지만 이 역시 개발 진척이 더뎌 수령하지 못했을 것으로 추정된다.
CS파마는 베르시포로신 중국 2상을 실시하고 2024년 상반기 결과를 예측했으나 현재까지 결과를 내지 못했다. CS파마 홈페이지에 따르면 베르시포로신은 여전히 임상 2상 초반에 머물러 있다.
개발 속도는 신약개발 경쟁력의 중요한 요소로 꼽힌다. 경쟁사보다 더 빠르게 신약을 개발해야 빠르게 시장을 점유할 수 있다. 특발성 폐섬유증은 기존 치료제 효과가 충분치 않지만 오랜 기간 승인된 신약이 없어 전 세계적으로 개발 경쟁이 치열하다.
2년간 별다른 진전 없이 계약이 해지됨으로써 중화권 시장에서 베르시포로신의 시장가치가 타격을 입은 것은 물론 대웅제약은 진출 전략을 다시 세워야 하는 상황이 됐다.
대웅제약 신약 포트폴리오 측면에서도 아쉬움이 남는다. 대웅제약의 신약 후보물질 중 유일하게 기술이전된 파이프라인이기 때문이다.
대웅제약 관계자는 "CS파마의 전략변경 내용이나 향후 개발전략, 마일스톤 수령 유무 등 구체적인 내용은 계약상 비밀유지의무로 답변이 힘들다"고 말을 아꼈다.
◇미국·한국 임상 영향 없어, IDMC 임상 권고 따른다
중화권 외 글로벌 진출은 대웅제약이 자체 개발을 이어가고 있어 영향이 없다. 2022년 베르시포로신은 다국가 임상 2상을 승인받아 현재 한국과 미국에서 개발을 진행 중이다. 당초 목표대로 연내 임상 2상을 완료한다면 통합 데이터를 발표할 예정이다.
베르시포로신에 대한 잠재력도 여전하다고 보고있다. 대웅제약은 작년 독립적 데이터 모니터링 위원회(IDMC)로부터 두 차례 베르시포로신의 임상 지속 권고를 받았다. 올해 예정된 3차 회의에서 베르시포르신 임상 2상의 안전성을 최종 점검한다.
IDMC는 객관성을 가진 독립 위원회로 임상 진행 단계에서 환자의 안전과 약물 효능 등을 독립적으로 모니터링한다. 특히 계열 내 최초 약물은 더 까다로운 잣대를 적용한다. IDMC 권고를 받음으로써 베르시포로신의 개발 가능성을 인정받았다는 설명이다.
베르시포르신의 적응증도 확대해나가고 있다. 임상 2상에 있는 특발성 폐섬유증 뿐만 아니라 켈로이드와 전신경화증에 대해 각각 임상 1상 승인, 임상 2상 준비 단계에 있다. 여기에 온코크로스, 대웅테라퓨틱스와 공동 연구를 통한 전임상 단계에서의 신규 적응증을 발굴하고 있다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- 에이비엘·컴퍼스, 기대보다 낮은 ORR에도 유의성 충족
- 애경산업, 대표 간담회 통해 매각 검토 공식화
- 지아이이노베이션 창업주 장명호, 4년만에 대표 복귀
- [i-point]서진시스템, 907억 규모 ESS 공급 계약 체결
- [Company Watch]인텔렉추얼디스커버리, 퓨리오사AI 추가 펀딩 참여
- [Company Watch]에스티아이, 반도체 인프라 투자 '수혜' 기대감
- [Company Watch]'해외 확장' 디이엔티, 미국·캐나다 법인 신설
- [Red & Blue]'설비투자 본격화' 심텍, 업황 회복 속 흑자전환 기대감
- [대양금속 편입나선 KH그룹]갈등만 키운 임시주총, 끝나지 않는 소모전
- [오너십 시프트]앱트뉴로사이언스, 힘들게 조달한 1000억 자금 줄줄이 '외부투자'
김혜선 기자의 다른 기사 보기
-
- [주주총회 현장 돋보기]보령 '홀로서기' 3세 김정균, '우주 올인' 우려 불식 총력
- 대웅제약, 더뎠던 中 폐섬유증 신약 반환 '시장성' 타격
- [주주총회 현장 돋보기]제일약품, 오너 3세 입지 강화…막 내린 '전문경영인' 시대
- 알피바이오, 순손실에도 재고관리 덕 '현금흐름' 확대
- [주주총회 현장 돋보기]'2세체제' 삼진제약, 최지현 대표 "공동경영 역할분담 유지"
- CG인바이츠, 정관에 '괌 병원' 포석…생태계 시너지 기대
- [배당정책 리뷰]HK이노엔, 모기업 한국콜마 '첫 배당'…소액주주 환원 축소
- 티움바이오, '키에지' 결별 타격 없다…자체 개발 '집중'
- 삼일제약, 베트남 법인 통큰 지원 '3년 더'
- [파마리서치 기업분석]상장과 동시에 10년간 배당 541억, 순익 기준 15% 환원























