셀트리온, '트룩시마'도 퍼스트무버 될까…연내 美 허가 유력 램시마에 이어 두번째…11월 넷째~12월 첫째주 FDA 최종 허가할 듯
강인효 기자공개 2018-10-11 16:13:31
이 기사는 2018년 10월 11일 16시12분 thebell에 표출된 기사입니다
|
◇FDA 항암제 자문위원회, 만장일치로 트룩시마 '승인 권고'
셀트리온은 10일(현지시간) 미국 메릴랜드주 FDA 화이트오크 캠퍼스에서 개최된 항암제 자문위원회(ODAC)에서 트룩시마(개발명 CT-P10)에 대해 만장일치로 '승인 권고' 의견을 받았다고 밝혔다. 자문위원회는 이날 회의에서 셀트리온과 FDA의 의견 발표 및 대중의견을 청취한 후 논의를 거쳐 승인에 대한 표결을 실시했고, 16명의 자문위원단 전원이 찬성 의견을 제출했다.
항암제 자문위원회는 FDA의 독립된 자문기구다. 미국에서 허가받는 의약품의 품질과 안전성뿐만 아니라 경제성 등을 사전에 검토한 뒤 종합 의견을 제공한다. 이 자문위원회의 결정은 FDA의 의약품 승인 결정에 중요한 참고 의견을 활용된다.
업계에선 트룩시마가 만장일치로 자문위원회의 승인 권고를 받은 만큼 미국 허가가 사실상 가시화된 것으로 보고 있다. 통상 자문위원회가 승인권고를 낼 경우 FDA는 2~3달 후에 공식 허가를 낸다. 셀트리온 측은 트룩시마가 오는 11월 넷째 주에서 12월 첫째 주 사이 FDA 최종 허가를 받을 것으로 예상하고 있다.
셀트리온이 개발한 트룩시마는 혈액암의 일종인 비호지킨스 림프종 등을 치료하는데 쓰이는 항체 바이오시밀러다. 트룩시마의 오리지널 의약품은 미국 바이오기업 바이오젠이 개발하고 스위스 제약사 로슈가 판매하는 '리툭산(성분명 리툭시맙)'이다.
리툭시맙은 세계에서 한 해 약 8조원 이상의 매출을 올리는 블록버스터 의약품이다. 미국은 약 5조원 규모의 리툭시맙 시장을 형성하고 있으며, 세계 리툭시맙 매출의 56%를 차지하고 있는 최대 시장이다.
◇램시마에 이어 트룩시마도 '퍼스트 무버' 등극
셀트리온은 트룩시마보다 앞서 2016년 4월 FDA으로부터 램시마의 판매 허가를 받았다. 자가면역질환 치료제 램시마는 미국 내에서 최초로 출시되는 항체 바이오시밀러였다. 램시마의 오리지널 의약품은 미국 제약사 얀센이 개발한 '레미케이드(성분명 인플릭시맙·미국 판매명 인플렉트라)'다.
셀트리온 관계자는 "트룩시마보다 앞서 미국에서 허가를 받은 램시마도 2016년 2월 열린 FDA 산하 관절염 자문위원회에서 '승인 권고' 의견을 받았다"며 "당시 24명의 자문위원단 중 21명의 자문위원이 찬성 의견을 제출했다"고 말했다.
연내 허가가 완료되면 트룩시마는 미국 내 리툭시맙 제제 바이오시밀러 중 퍼스트 무버로 등극할 전망이다. 무엇보다 바이오시밀러 시장에서는 퍼스트 무버 자리를 차지하는 것이 중요하다. 퍼스트 무버 바이오시밀러는 오리지널 의약품과의 가격 경쟁에서 우위에 설 수 있을 뿐만 아니라 선점 효과로 후속 바이오시밀러보다 시장을 장악하는데 유리하다.
셀트리온은 미국에 앞서 유럽에서 먼저 트룩시마를 허가받았다. 2017년 2월 리툭시맙 바이오시밀러 개발 기업 중 처음으로 유럽의약품청(EMA)으로부터 판매 허가를 받으며 트룩시마는 리툭시맙 제제의 퍼스트 무버 바이오시밀러로 등극했다.
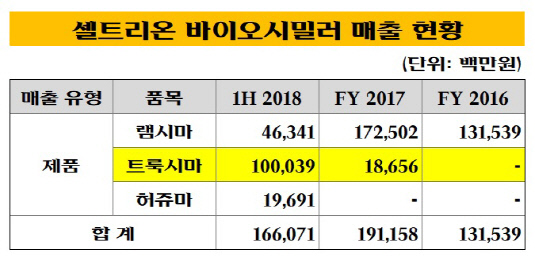
트룩시마는 2017년 4월 영국에서 처음 출시됐고, 올해 6월 기준 유럽 18개국에서 판매되고 있다. 트룩시마는 올해 상반기말 기준 네덜란드와 영국에서 오리지널 의약품 시장의 66%와 56%를 각각 대체하며 순항 중이다. 또 유럽 전체로 볼 때 오리지널 의약품 시장에서 약 27%의 점유율을 보이고 있다. 그 결과 지난해 187억원에 불과하던 트룩시마 매출도 올해 상반기 기준 1000억원으로 5배 이상 껑충 뛰었다.
|
셀트리온은 램시마에 이어 트룩시마도 퍼스트 무버에 등극할 가능성이 높아진데다 미국 정부가 최근 예고한 바이오시밀러 확대 정책 덕분에 트룩시마의 현지 시장 진입과 매출 증대에 큰 도움이 될 것으로 기대하고 있다. 미국 정부는 △바이오시밀러의 개발 및 승인과정 효율화 △바이오시밀러 이해도를 높이기 위한 환자, 의사, 보험사와의 효율적 커뮤니케이션 △공정한 시장경쟁 장려 등을 주요 골자로 한 '바이오시밀러 육성정책(Biosimilars Action Plan·BAP)'을 통해 바이오시밀러 도입과 경쟁을 촉진하겠다는 뜻을 밝힌 바 있다.
기우성 셀트리온 대표는 "트룩시마가 FDA 자문위원회의 승인 권고를 받은 미국 최초의 리툭시맙 바이오시밀러가 된 것을 자랑스럽게 생각한다"며 "셀트리온은 높은 의약품 가격으로 인해 치료 기회를 갖지 못했던 미국의 환자들에게 오리지널 의약품과 동등한 치료 효과를 가진 바이오시밀러 치료 혜택을 제공함으로써 환자의 삶의 질 제고에 더욱 힘쓰겠다"고 밝혔다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 키움증권 리테일 훼손 우려…이틀새 시총 2400억 증발
- 더본코리아, '노랑통닭' 인수 포기 배경은
- [i-point]탑런에이피솔루션, LG디스플레이 장비 공급 업체 등록
- [트럼프 제재 나비효과 '레드테크']한국 울리는 적색경보, 차이나리스크 확산
- [i-point]티사이언티픽, 파트너스 데이 성료…"사업 확장 속도"
- [i-point]빛과전자, 국제 전시회 참여 "미국 시장 확대"
- [탈한한령 훈풍 부는 콘텐츠기업들]잠잠한 듯했는데…JYP엔터의 중국 굴기 '반격 노린다'
- [LGU+를 움직이는 사람들]권준혁 NW부문장, 효율화 vs 통신품질 '균형' 숙제
- [저축은행경영분석]PF 늘린 한투저축, 순익 2위 등극…사후관리 '자신감'
- [저축은행경영분석]'PF 후폭풍' OK저축, 대손상각 규모만 3637억