삼성에피스, 후속 파이프라인 기대감에 기업가치 껑충 증권사 추정 밸류에이션 10조→20조…작년 첫 흑자 달성에 안과질환 치료제 개발 임박
강인효 기자공개 2020-08-31 07:35:47
이 기사는 2020년 08월 28일 13시10분 thebell에 표출된 기사입니다
삼성바이오로직스 자회사인 삼성바이오에피스의 기업가치(밸류에이션)가 크게 올랐다.미국 바이오젠이 삼성바이오로직스에 콜옵션(주식매수청구권) 행사한 2018년 7월과 비교하면 밸류에이션은 2배 넘게 상승했다. 삼성바이오에피스는 작년 사상 처음으로 흑자 달성에 성공한 데 이어 올해 후속 파이프라인에 대한 기대감도 높이고 있다.
◇증권사 추정 기업가치 10조→20조
29일 증권업계에 따르면 3곳의 증권사가 추정한 삼성바이오에피스의 기업가치 평균은 20조7440억원이다.
한국투자증권, NH투자증권, KTB투자증권 등 3곳의 증권사는 지난달 22일 삼성바이오로직스에 대한 보고서를 냈다. 삼성바이오로직스의 2분기 잠정 실적에 대한 리뷰 성격의 보고서로 자회사인 삼성바이오에피스에 대한 평가도 담겨 있다.
밸류에이션 산정시 적용된 평가법은 현금흐름할인법(DCF)으로 미래현금흐름을 추정해 1주당 가치를 산출했다. 한국투자증권, NH투자증권, KTB투자증권 3곳의 증권사가 추정한 삼성바이오로직스의 보유 지분(50%+1주) 가치는 각각 12조7559억원, 약 11조원, 10조5980억원이었다. 이를 역산하면 3곳의 증권사가 추정한 삼성바이오에피스의 기업가치는 각각 25조4480억원, 22조890억원, 21조1960억원이 된다.
한국투자증권 평가로 보면 삼성바이오에피스의 기업가치는 2년 전 12조8760억원에서 2년 만에 25조4480억원으로 2배 넘게 올랐다. 다른 증권사들도 두배 이상 기업가치를 높게 평가했다.
삼성바이오에피스는 2012년 삼성바이오로직스가 85%의 지분을 가진 삼성 중심의 합작사로 설립됐다. 나머지 15%는 바이오젠이 갖고 있었다. 지난 2018년 6월 바이오젠이 삼성바이오에피스에 대한 콜옵션을 행사하면서 지분을 5:5로 나눠 갖게 됐다. 삼성바이오로직스가 50%+1주를, 바이오젠이 50%-1주를 보유하는 구조다.
삼성바이오에피스는 2012년 창사 이래 처음으로 지난해 흑자 달성에 성공했다. 상업화에 성공한 주력 바이오시밀러(바이오의약품 복제약) 제품의 실적 성장세가 가파르다. 여기에 개발 중인 후속 파이프라인에 대한 기대감도 긍정적인 영향을 미치고 있다.
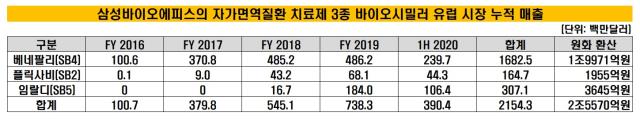
삼성바이오에피스의 지난해 연결기준 매출액과 영업이익은 각각 7659억원, 1228억원이었다. 매출은 2018년보다 2배 이상 늘어나며 사상 최대치를 기록했다. 영업이익률은 16%였다.
삼성바이오에피스의 매출 확대의 일등 공신인 주력 바이오시밀러 제품의 유럽 판매 호조 덕분이다. 지난해에는 유럽 외 지역에서의 판매까지도 폭발적으로 증가하며 외형 성장을 견인했다.
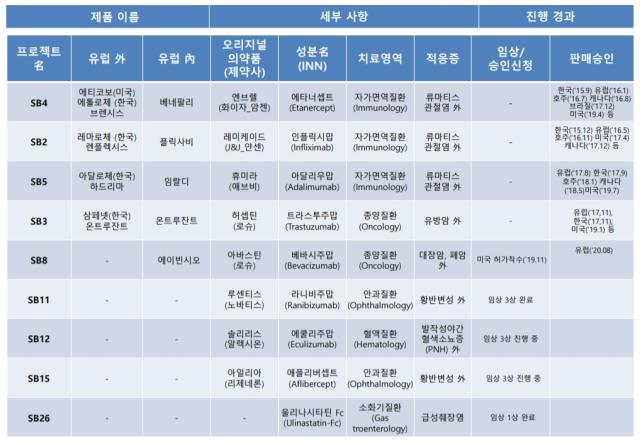
삼성바이오에피스는 현재 유럽에서 △SB4(이하 오리지널의약품 엔브렐) △SB2(레미케이드) △SB5(휴미라) △SB3(허셉틴) △SB8(아바스틴) 등 총 5개의 바이오시밀러 제품을 허가받아 판매하고 있다. SB4, SB2, SB5는 자가면역질환 치료제이며, SB3와 SB8은 각각 유방암, 대장암을 치료하는데 쓰이는 항암제다.
삼성바이오에피스는 지난 2015년 앞으로 총 13개의 바이오시밀러를 개발하겠다는 계획을 발표했다. 이미 상업화에 성공한 이들 5개 제품을 '첫 번째 물결(1st wave)'이라고 부른다. SB8을 제외하곤 모두 미국에서도 이미 허가를 받은 제품들이다. SB8은 작년 11월 미국 식품의약국(FDA)에 판매 허가 신청을 하고 현재 심사 중에 있다.
삼성바이오에피스는 후속 파이프라인 개발에도 속도를 내고 있다. 이들 후속 파이프라인 개발 프로젝트명을 '두 번째 물결(2nd wave)'이라고 붙였다. 지난해 말 황반변성 치료제인 '루센티스' 바이오시밀러 SB11의 글로벌 임상 3상을 완료했다. 연내 유럽과 미국에 판매 허가를 신청한다는 계획이다.
또 발작성 야간 혈색소뇨증(PNH) 치료제인 '솔리리스' 바이오시밀러 SB12의 글로벌 임상 3상을 진행 중으로 내년 10월 안에 마무리할 것으로 전망된다. 삼성바이오에피스의 두 번째 안과질환 치료제인 '아일리아' 바이오시밀러 SB15는 글로벌 임상 3상을 추진할 예정이다. 오는 2022년 2월까지 임상을 완료할 계획이다.
회사 관계자는 "상업화에 성공한 5종의 선행 과제(1st wave) 제품 판매를 확대해 나가면서 후속 과제(2nd wave) 제품의 개발도 잘 진행해 지속 성장이 가능한 기업으로 자리매김하기 위해 노력하겠다"고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [트럼프 제재 나비효과 '레드테크']한국 울리는 적색경보, 차이나리스크 확산
- [i-point]티사이언티픽, 파트너스 데이 성료…"사업 확장 속도"
- [i-point]빛과전자, 국제 전시회 참여 "미국 시장 확대"
- [탈한한령 훈풍 부는 콘텐츠기업들]잠잠한 듯했는데…JYP엔터의 중국 굴기 '반격 노린다'
- [LGU+를 움직이는 사람들]권준혁 NW부문장, 효율화 vs 통신품질 '균형' 숙제
- [저축은행경영분석]PF 늘린 한투저축, 순익 2위 등극…사후관리 '자신감'
- [저축은행경영분석]'PF 후폭풍' OK저축, 대손상각 규모만 3637억
- [여전사경영분석]IBK캐피탈, 지분법 손실에 순익 '뒷걸음'…올해 GP 역량 강화
- 우리은행, 폴란드에 주목하는 이유
- [Policy Radar]금감원, MBK발 사모펀드 전방위 점검...LBO 방식 손볼까























