[ESMO 2023 review]졸베툭시맙 넘보는 에이비엘바이오, 삼중병용 차별화그랩바디-T 적용 첫 이중항체, 상업화 'Claudin18.2' 타깃 안정성 입증
최은진 기자공개 2023-10-30 10:36:04
[편집자주]
블록버스터 항암제라면 거쳐야 할 세계 최대 암학회, ESMO 2023(유럽종양학회)이 10월 20일부터 닷새간의 여정으로 열렸다. 키트루다·엔허투를 이을 블록버스터급 후보작이 누가 될 지에 관심이 집중됐다. 한때 '주변인'에 머물렀던 국내사들의 존재감도 커졌다. 올해 ESMO에는 약 15곳의 국내 제약·바이오 기업들이 각사의 기술력을 담은 연구 결과를 발표했다. 더벨은 주목해야 할 국산 신약의 데이터를 리뷰해보고 향후 개발전략을 조명해봤다.
이 기사는 2023년 10월 27일 15시21분 thebell에 표출된 기사입니다
파킨슨병 치료제로 사노피와의 빅딜을 이룬 에이비엘바이오가 내세우는 두 번째 파이프라인은 항암치료제다. 4-1BB 이중항체 플랫폼 그랩바디-T가 적용된 첫번째 파이프라인으로 'Claudin18.2'를 타깃하는 물질이다.하지만 글로벌 속도를 감안하면 개발속도는 다소 늦다. 이를 돌파하는 게 안정성, 부작용을 최소화 하는 방식이다. 임상 1상을 진행하는 과정에서 이 같은 에이비엘바이오의 전략에 힘을 실어주는 중간데이터가 발표됐다.
◇ABL111 통한 베스트 포스터 어워즈 수상, 아이맵과 공동개발
에이비엘바이오는 '2023 유럽종양학회(European Society for Medical Oncology 2023, ESMO 2023)'에서 'ABL111(TJ-CD4B, Givastomig)'의 임상 1상 중간 데이터를 소개했다. 임상 단계의 면역항암제(Investigational Immunotherapy) 포스터 세션에서 '베스트 포스터 어워드(Best Poster Award)'를 수상하기도 했다.
ABL111은 나스닥 상장사 아이맵(I-Mab)과 공동 개발하는 이중항체 파이프라인이다. 포스터 발표도 아이맵이 담당했다. 발표된 임상 데이터는 미국과 중국에서 진행 중인 건으로 ABL111의 용량 증량(Dose Escalation) 파트와 용량 확장(Dose Expansion) 파트에 대한 분석이 담겼다.
용량은 2주 간격으로 정맥 투여한 0.1mg/kg에서 시작해 최대 15mg/kg까지 증량했다. 최대용량까지의 투여에서 용량제한독성(DLT)은 발견되지 않았다. 최대허용용량(MTD)에도 도달하지 않았다.
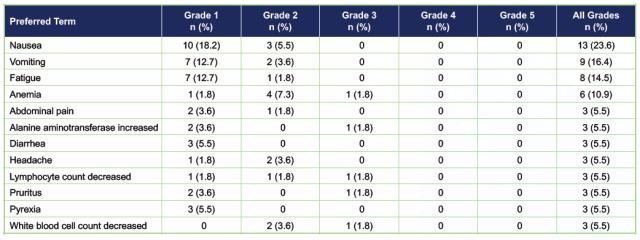
55명의 재발/난치성 고형 종양 환자 중에서 5% 이상에서 발생한 12개의 TRAE(Treatment-related Adverse Event, 치료 관련 이상반응) 가운데 생명을 위협할 수 있는 Grade 4 이상의 이상반응이 확인되지 않았다. 대상자의 10% 이상에서 보고되는 가장 흔한 TRAE는 메스꺼움(23.6%), 구토(16.4%), 피로감(14.5%), 빈혈(10.9%) 등이 있었다.
효능 데이터도 발표됐다. 단독요법 1상의 대상자 CLDN18.2 발현도 1% 이상 총 55명 가운데 평가가 가능한 17명에게서 PR(부분관해) 4건, ORR(객관적반응률) 24%, CBR(임상적유익성) 41%가 도출됐다.
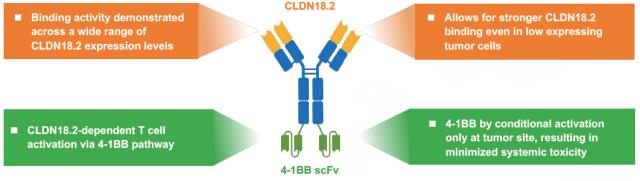
ABL111은 Claudin18.2(CLDN18.2) 및 4-1BB를 표적으로 하는 이중항체다. 위암 및 식도암 치료제 개발을 타깃한다. CLDN18.2를 발현하는 암에서 선택적으로 T세포를 활성화시키는 기전이다. 경쟁 CAR-T와 비교해 상대적으로 부작용 우려가 적다는 점을 특이점으로 내세웠다.
◇졸베툭시맙 3상 데이터 도출 단계, 화학치료제+PD-(L)1 병용임상 추진
현재 글로벌에서 Claudin18.2를 타깃하는 다양한 치료제가 개발되고 있지만 가장 빠른 곳은 글로벌 제약사 아스텔라스(Astellas)가 개발한 Claudin18.2 단일항체 '졸베툭시맙(Zolbetuximab)'이다. 현재 3상이 진행 중이고 긍정적인 중간 데이터가 나온 데 따라 미국 식품의약국(FDA) 승인 기대감이 높아지고 있다. 화학치료제 병용요법 1차 치료제로는 현재 미국, 유럽, 중국, 일본에서 승인 심사 중이다.
에이비엘바이오는 아스텔라스의 졸베툭시맙 대비 후발주자다. 그러나 안정성과 효능면에서 앞서는 데이터가 도출되면서 추후 개발 가능성에 대한 기대감이 커지고 있다. 졸베툭시맙은 2a상 단독요법에서 TRAE가 전체 환자 54명 중 약 10%에서 나타났다. 중대한 이상사례에 해당하는 Grade 5도 8건이나 있었다. ABL111은 중대한 이상사례가 단 한건도 없었던만큼 안정성에서 우위를 점했다는 평가다.
효능면에서도 졸베툭시맙 단독 및 병용 2a상에서 CLDN18.2 발현도 50% 이상 43명에게서 ORR 9%, CBR 23%가 도출됐다. CLDN18.2 발현도 70% 이상 29명에게는 ORR 14%, CBR 31%가 나왔다.
이 같은 안정성과 효능 외에도 에이비엘바이오는 졸베툭시맙보다 늦은 후발주자인 만큼 삼중병용요법이라는 새로운 개발 전략을 내세울 방침이다. 화학치료제에 더해 최근 위암 표준치료제로 승인받은 PD-(L)1까지 아우르는 방식의 임상이다. 졸베툭시맙도 마찬가지로 삼중치료요법을 승인받기 위해선 또 처음부터 임상을 시작해야 하는만큼 에이비엘바이오 입장에선 더 빨리 우위를 점할 수 있다는 계산이다.
단독요법와 삼중병용요법 투트랙 전략으로 추진할 예정인 가운데 단독요법은 내년 1상이 마무리 될 것으로 기대된다.
에이비엘바이오 관계자는 "CLDN18.2이 타깃으로 입증되면서 각광받고 있는 상황에서 단독요법 1상에서 안정성과 효능에 대한 유의미한 데이터를 받았다"며 "후발주지이지만 삼중치료요법 개발에 나서 경쟁력을 확보할 것"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [i-point]'킵스파마 계열' 알곡바이오, 이데트렉세드 임상 환자 모집
- [Company Watch]코인원, 적자 감수 '신규 고객 유입' 마케팅 투자 지속
- [Red & Blue]롤러코스터 주가 한진칼, '경영권 분쟁 vs 시세 차익'
- [i-point]제이엘케이, 네이처 자매지에 논문 게재
- 롯데캐피탈, 순익 줄었지만 부실 털기로 건전성 개선
- 동양생명, 제도 변경 영향에 보험손익 급감
- [이사회 분석]SBI저축, 모리타 SBI홀딩스 전무 사임…차기 의장은
- [저축은행 위험 관리 점검]애큐온저축, 선제적 신용 관리로 건전한 자산 중심 경영
- [우리금융 인사 풍향계]임종룡 회장 '독립 경영' 방침 드러난 보험사 CEO 선임
- [저축은행 서민금융 리포트]웰컴저축, 금융권 저신용자 대출 '최후의 보루'























