보로노이, 이유있는 미국 1a상 취하 "초기임상 속도 낸다" VRN11 용량증량시험 코호트군 달라 임상 지연 예상, 한국·대만서만 진행
정새임 기자공개 2024-07-17 08:17:11
이 기사는 2024년 07월 16일 07시52분 thebell에 표출된 기사입니다
보로노이가 4세대 폐암 신약 파이프라인 'VRN11'의 빠른 임상 진행을 위해 미국 1a상을 포기했다. 1a 임상을 한국과 대만에서 실시한 후 1b상부터 미국에서 진행할 계획이다. 초기 임상에 많은 시간을 할애하지 않겠다는 전략적 판단으로 보인다.보로노이는 15일 미국 식품의약국(FDA)에 제출한 VRN11 1상 임상시험계획(IND)을 자진 취하했다고 공시했다. 한국과 대만에서 진행하는 임상을 미국에서도 실시하기 위해 제출한 IND를 철회한 게 골자다. VRN11은 EGFR 변이 비소세포폐암 환자 중 타그리소 내성이 생긴 환자를 타깃하는 신약이다.
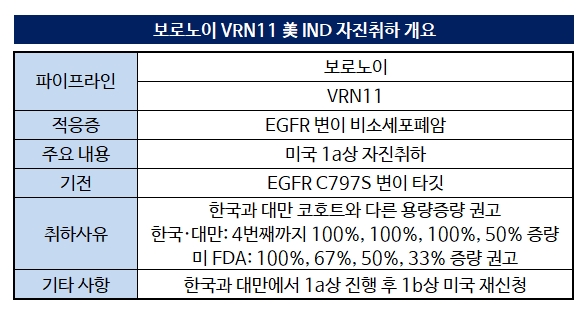
미국에 제출했던 1상은 용량증량시험인 1a상과 용량확장시험인 1b상으로 구성된다. 1a상에서는 용량을 단계적으로 증량해 약물의 최대내약용량(MTD)과 용량제한독성(DLT)을 평가하고 1b상에서 약효와 안전성, 내약성을 담보하는 최적 용량을 결정한다.
당초 한국과 대만에서 1a상을 실시한 후 미국은 1b상부터 진입하려던 계획은 FDA와의 협의 과정에서 1a상부터 진행하는 것으로 수정됐다. 타그리소 내성이 생긴 환자들이 쓸 적절한 약제가 부재한 상황에서 FDA는 첫 임상부터 미국에서 실시하도록 권고했고 이를 보로노이가 받아들였다.
하지만 FDA가 권고한 용량군(코호트)이 기존에 계획한 임상 디자인과 달라 발목을 잡았다. 한국과 대만에서 진행하기로 한 4번째까지의 용량 증량 단계는 100%, 100%, 100%, 50% 였다. 이에 따라 10, 20, 40, 80mg 순으로 코호트를 구성했다.
반면 FDA는 피보나치 모형에 따라 100%, 67%, 50%, 33% 증량을 권고했다. 2번째 코호트부터 완전히 새로운 그룹을 만들어야 한다. 한국과 대만 임상과 디자인이 달라 분석이 통일되지 않을뿐 아니라 임상 기간도 훨씬 늘어난다. 한국에서 보로노이가 예상한 1상 기간은 2026년 12월까지다.
결국 보로노이는 미국 IND를 포기하고 한국과 대만에서 1a상을 진행하기로 결정했다. 초기 임상에 너무 많은 시간을 쏟다 경쟁력을 잃을 수 있다는 판단이다. VRN11가 타깃하는 타그리소 내성이 생긴 폐암은 아직 허가받은 신약이 없지만 개발이 치열하게 진행되고 있다. 국내뿐 아니라 글로벌 기업 다수가 뛰어들었다.
한국과 대만에서 빠르게 1a상을 진행한 후 미국에서 1b상을 진행할 계획이다. 최근 임상이 가속화되면서 빠른 시간 내 증량 시험을 마칠 수 있을 것으로 보고 있다.
보로노이 관계자는 "미국 IND 자진취하로 원래 VRN11 개발 계획대로 돌아간 것"이라며 "한국과 대만에서 최적 약효용량까지 증량한 후 미국에서 임상을 진행해 속도를 높일 것"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 키움증권 리테일 훼손 우려…이틀새 시총 2400억 증발
- 더본코리아, '노랑통닭' 인수 포기 배경은
- [i-point]탑런에이피솔루션, LG디스플레이 장비 공급 업체 등록
- [트럼프 제재 나비효과 '레드테크']한국 울리는 적색경보, 차이나리스크 확산
- [i-point]티사이언티픽, 파트너스 데이 성료…"사업 확장 속도"
- [i-point]빛과전자, 국제 전시회 참여 "미국 시장 확대"
- [탈한한령 훈풍 부는 콘텐츠기업들]잠잠한 듯했는데…JYP엔터의 중국 굴기 '반격 노린다'
- [LGU+를 움직이는 사람들]권준혁 NW부문장, 효율화 vs 통신품질 '균형' 숙제
- [저축은행경영분석]PF 늘린 한투저축, 순익 2위 등극…사후관리 '자신감'
- [저축은행경영분석]'PF 후폭풍' OK저축, 대손상각 규모만 3637억
정새임 기자의 다른 기사 보기
-
- [와이바이오로직스 항암신약 로드맵]'뉴 모달리티' 도전 자신감, 원석 광산 플랫폼 'Ymax-ABL'
- 알테오젠 자회사, '개발·유통' 일원화…2인 대표 체제
- [인투셀 IPO]든든한 자산 '사옥'에 100억 차입, 창업주 지분 사수 기반
- 유한양행 '렉라자 병용'이 쓴 생존기간 "치료기준 바꿨다"
- [와이바이오로직스 항암신약 로드맵]R&D 전략 재수립, 후발주자에서 '퍼스트 무버' 입지로
- 루닛, 흑자전환 시점 연기…볼파라 효과 가시화는 '고무적'
- 60주년 맞은 휴온스, 윤성태 회장 복귀 "해외 사업 챙긴다"
- [주주총회 현장 돋보기]삼양 바이오 새 수장 김경진 사장 "CDMO 글로벌 확장"
- [주주총회 현장 돋보기]루닛의 새 조력자 이준표 SBVA 대표, '카이스트' 인연
- [이뮨온시아 IPO]자사주 활용한 신주모집 효과, 유한양행 '통 큰 결정'























