셀트리온, 美 트룩시마 허가로 램시마 성공 넘어설까 경쟁사 시장진입 포기로 퍼스트무버 확고…"오리지널 리베이트 수준 낮아 공격적 약가정책 가능"
강인효 기자공개 2018-11-29 16:06:47
이 기사는 2018년 11월 29일 15시53분 thebell에 표출된 기사입니다
|
셀트리온은 28일(현지 시각) 미국 식품의약국(FDA)으로부터 트룩시마의 판매 허가를 받았다고 밝혔다. 트룩시마는 혈액암의 일종인 비호지킨스 림프종 등을 치료하는 데 쓰이는 항체 바이오시밀러다. 셀트리온이 국내 공장에서 트룩시마를 생산한 뒤 이를 계열사인 셀트리온헬스케어에 납품하고, 셀트리온헬스케어는 북미 판권을 보유한 다국적 제약사 테바를 통해 트룩시마를 미국에 판매할 예정이다.
◇트룩시마, 미국 시장 10%만 점유해도 연매출 5000억원 신규 발생 기대
트룩시마의 오리지널 의약품은 미국 바이오기업 바이오젠이 개발하고 스위스 제약사 로슈가 판매하는 '리툭산(성분명 리툭시맙)'으로, 리툭산은 세계에서 한 해 약 8조원 이상의 매출을 올리는 글로벌 블록버스터 의약품이다. 미국은 약 5조원 규모의 리툭시맙 시장을 형성하고 있으며, 세계 리툭시맙 매출의 56%를 차지하고 있는 최대 시장이기도 하다.
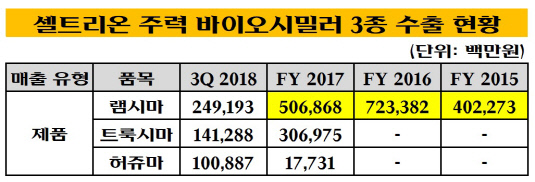
셀트리온의 퍼스트 무버 바이오시밀러로 트룩시마보다 앞서 미국에 진출한 램시마가 올해 출시 2년 만에 두 자릿수 시장 점유율을 기록할 것으로 전망되고 있다. 김형기 셀트리온헬스케어 부회장은 최근 기자와 만난 자리에서 "트룩시마보다 앞서 미국에 진출한 램시마의 현지 시장 점유율이 아직까지는 낮은 편이지만, 올해 연말까지 시장 점유율 13~15%를 달성하는 것을 목표로 하고 있다"면서 "트룩시마가 내년에 출시되면 셀트리온 바이오시밀러의 미국 시장 공략이 본격화될 것"이라고 밝힌 바 있다.
보수적으로 가정해 셀트리온이 미국 리툭시맙 제제 시장의 10%만 차지하더라도 회사가 거둘 수 있는 신규 매출은 5000억원에 달한다. 셀트리온의 작년 연결기준 매출액은 9491억원으로 1조원 달성을 눈앞에 둔 상황이었다. 올해 3분기까지 누적 매출은 7395억원으로 지난해보다 10%가량 증가했다. 트룩시마가 미국 시장에서 퍼스트 무버로 제대로 자리 잡는다면 내년 연매출은 1조원을 훌쩍 뛰어넘을 것으로 예상된다.
바이오업계 관계자는 "바이오의약품의 경우 한 번 처방하면 쉽게 후속 제품으로 변경하지 않는다"면서 "그렇기 때문에 오리지널 의약품과의 가격 경쟁에서 우위에 설 수 있는 퍼스트 무버 바이오시밀러는 후속 바이오시밀러와의 주도권 싸움에서 절대적으로 유리하다"고 말했다.
◇트룩시마, 퍼스트 무버 지위 확고…경쟁사 미국 시장 진출 포기도 호재
트룩시마의 경우 경쟁사가 최근 미국 시장 진출을 포기한 데다 미국 판매사인 테바가 항암제 분야에 강력한 포트폴리오와 마케팅 네트워크를 구축하고 있다는 점도 긍정적이다. 후속 경쟁 제품의 출시도 빨라야 2년 후인 만큼 트룩시마의 퍼스트 무버 지위도 확고하다.
리툭시맙 바이오시밀러 경쟁사였던 산도즈는 지난 2일 미국 시장 진출을 포기한다고 밝혔다. 다국적 제약사 노바티스의 바이오시밀러 자회사인 산도스는 지난해 9월 FDA에 리툭시맙 바이오시밀러인 '리삭톤' 허가 신청을 했지만 올해 5월 FDA로부터 최종 보완요구 공문(CRL)을 받으면서 승인이 지연된 바 있다. 산도즈가 미국 시장에 리삭톤을 트룩시마보다 빠르게 출시할 수 없다는 판단을 내리고 미국 시장을 포기한 것으로 풀이된다.
다른 경쟁사 바이오시밀러도 향후 1년간은 미국 시장에 진출할 가능성이 낮다. 현재 트룩시마와 가장 가까운 경쟁자로는 화이자의 'PF-05280586(개발명)'이 있다. 화이자는 지난 9월 FDA에 해당 바이오시밀러에 대한 허가 신청서를 접수해 허가 시기는 2019년 3분기로 예상되는 만큼 트룩시마와의 격차는 최소 7개월 이상 발생한다.
이밖에 암젠의 'ABP-798(개발명)'과 아키젠의 'SAIT-101(개발명)' 등 트룩시마의 또다른 경쟁자의 경우 현재 미국 임상 3상이 진행 중에 있다. 내년 상반기 중으로 미국 임상 3상이 종료될 것으로 예정돼 있어 리툭시맙 바이오시밀러 세 번째 제품은 2020년 하반기에나 미국 시장에 진입이 가능할 것으로 예상된다.
◇램시마보다 가격 경쟁력 확보에도 유리
트룩시마의 경우 가격 경쟁력 확보가 유리하다는 장점도 있다. 이태영 KB증권 연구원은 "리툭산은 램시마의 오리지널 의약품인 레미케이드와는 달리 오리지널 의약품의 리베이트 수준이 높지 않다"며 "따라서 초기부터 공격적인 약가 정책을 통해 미국 사보험회사의 처방의약품 목록에 등재되는 것에 도전할 것으로 예상된다"고 밝혔다.
항암제인 리툭시맙 제제 시장에서는 미국 보험사 진입에 제한이 없다는 점도 트룩시마에게 유리하다. 미국에서 의료보험 혜택을 받기 위해서는 공보험 또는 사보험에 가입해야만 한다. 환자는 보험 가입 후 각각의 보험사에서 제공하는 의약품 급여 목록 내에서 처방을 받을 수 있는데, 램시마가 미국 출시 당시 부진한 성적을 거둔 이유 중에 하나가 바로 미국 보험사 진입에 실패했기 때문이다.
이 연구원은 "트룩시마의 오리지널 의약품인 리툭산의 주요 특허 만료 시점은 올해 12월 18일"이라면서 "트룩시마 판매사인 셀트리온헬스케어와 마케팅 파트너사인 테바가 미국 시장 조기 진입을 위한 준비 작업 진행 중"이라고 덧붙였다.
기우성 셀트리온 대표는 "트룩시마의 미국 승인은 리툭시맙 바이오시밀러 치료를 필요로 하는 미국의 환자들에게도 중요한 이정표로 생각한다"며 "미국 환자들에게 오리지널 의약품과 동등한 치료 효과를 가진 바이오시밀러 치료 혜택을 제공해 환자들의 삶의 질 제고에 더욱 힘써나가겠다"고 밝혔다.
|
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 키움증권 리테일 훼손 우려…이틀새 시총 2400억 증발
- 더본코리아, '노랑통닭' 인수 포기 배경은
- [i-point]탑런에이피솔루션, LG디스플레이 장비 공급 업체 등록
- [트럼프 제재 나비효과 '레드테크']한국 울리는 적색경보, 차이나리스크 확산
- [i-point]티사이언티픽, 파트너스 데이 성료…"사업 확장 속도"
- [i-point]빛과전자, 국제 전시회 참여 "미국 시장 확대"
- [탈한한령 훈풍 부는 콘텐츠기업들]잠잠한 듯했는데…JYP엔터의 중국 굴기 '반격 노린다'
- [LGU+를 움직이는 사람들]권준혁 NW부문장, 효율화 vs 통신품질 '균형' 숙제
- [저축은행경영분석]PF 늘린 한투저축, 순익 2위 등극…사후관리 '자신감'
- [저축은행경영분석]'PF 후폭풍' OK저축, 대손상각 규모만 3637억