바이오솔루션, 카티로이드 임상 철회…자료보완 후 재도전 식약처, 동물시험 추가 데이터 요구 조치…"파이프라인 구조조정 소문도 사실 아냐"
김형석 기자공개 2024-06-18 09:50:39
이 기사는 2024년 06월 17일 14:41 thebell 에 표출된 기사입니다.
바이오솔루션이 연골세포치료제 카티로이드의 임상을 자진철회한 가운데 내년께 재추진 의지를 피력했다. 규제당국이 요구한 자료를 보완해 다시 임상계획신청서(IND)를 제출한다는 계획이다. 항간에서 떠도는 파이프라인 구조조정에 대해서도 선을 긋고 있다.◇IND 자진철회 동물시험 추가자료 확보 차원
바이오솔루션은 13일 공시를 통해 카티로이드의 임상 1/2상을 자진철회한다고 밝혔다. 작년 8월 식품의약품안전처에 관련 임상 계획을 제출한 지 10개월만이다. 식약처가 전임상 데이터를 보완하라고 요구했지만 기간을 맞출 수 없다는 판단으로 철회를 선택했다.
당초 바이오솔루션은 중대 동물인 염소를 활용한 동물실험 결과를 식약처에 제출했다. 염소에 해당 물질을 이식하면서 최대치의 면역 억제제를 사용했지만 면역 거부반응으로 이상적인 결과를 도출하지 못했다.
식약처는 최대치 이상의 면역억제제를 투여한 결과를 요구했다. 바이오솔루션의 이의 제기에 식약처는 최대치 이상의 면역억제제 투입을 하지 않는 대신 누드 마우스(면역 억제 유전자 변형 쥐)를 대상으로 한 시험 결과 제출로 합의를 봤다. 추후 이에 대한 데이터를 확보할 것으로 보인다.
연골치료제의 특성상 시험 결과를 도출하기 위해선 6개월의 추적관찰이 필요하다. 바이오솔루션이 IND를 제출한 지 10개월이 지났다. 통상적으로 식약처는 IND 제출 60일 내에 승인 가부를 결정하는 것을 감안하면 자진 철회 없이는 해당 물질의 임상 승인을 받기 어려운 상황이다.
카티로이드는 골관절염과 외상 등으로 인한 관절연골 결손 치료를 목적으로 개발중인 물질이다. 동종세포치료제로서 자가조직 채취를 위한 수술이 불필요해 환자 편의성이 높고, 공여자 한 명에서 수십만 명분의 제품을 생산할 수 있어 대량생산을 통한 가격경쟁력도 갖출 수 있어 상업성이 뛰어난 물질로 기대를 모았다.
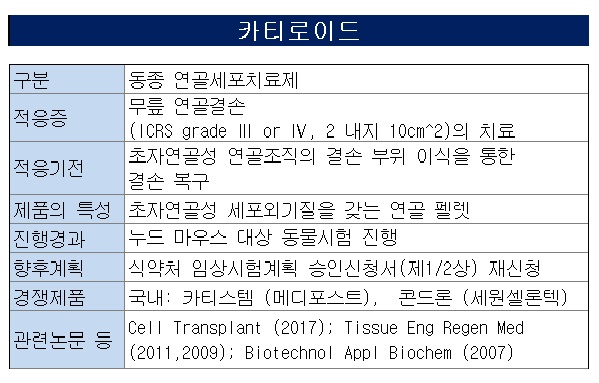
바이오솔루션은 내년 초 식약처에 IND를 다시 제출하고 본임상을 시작한다는 방침이다. 자진철회는 어디까지나 데이터 확보를 위해 필요한 시간을 버는 것일 뿐 파이프라인을 접는 건 아니라는 얘기다.
장송선 바이오솔루션 대표는 더벨과의 통화에서 "연골 치료제의 경우 중대동물을 대상으로 한 동물실험 데이터가 필요한 만큼 염소를 활용한 시험 데이터를 제출했지만 식약처에선 최대 허용량 이상의 면역억제제를 투여한 결과를 추가로 요구한 상황"이라며 "추가 동물시험 결과를 제출하는데 6개월 이상이 기간이 필요한 것을 감안하면 자체 철회 후 새롭게 IND를 신청하는 것이 낫다고 내부적으로 판단했다"고 말했다.
◇ 흑자 전환 위한 파이프라인 구조조정 일축
일각에서는 카티로이드 임상을 자진철회한 것을 두고 R&D 비용 절감을 위해 파이프라인을 구조조정 하고 있다는 의문을 제기하고 있다. 적자가 지속되는 상황에서 헬릭스미스 인수라는 부담까지 안은데 따른 결론으로 해석됐다. 그러나 바이오솔루션은 이에 대해 사실이 아니라고 밝혔다.
바이오솔루션은 2019년 19억원의 영업적자를 기록한 뒤 지난해까지 5년간 흑자 전환에 실패했다. 지난해 말 헬릭스미스를 인수하며 재무부담이 가중된 것도 흑자전환이 필요한 이유로 꼽힌다. 바이오솔루션은 헬릭스미스의 3자배정 유상증자에 참여하는데 365억원을 투입했다. 이는 당시 자기자본 대비 83.55%에 달하는 액수다.
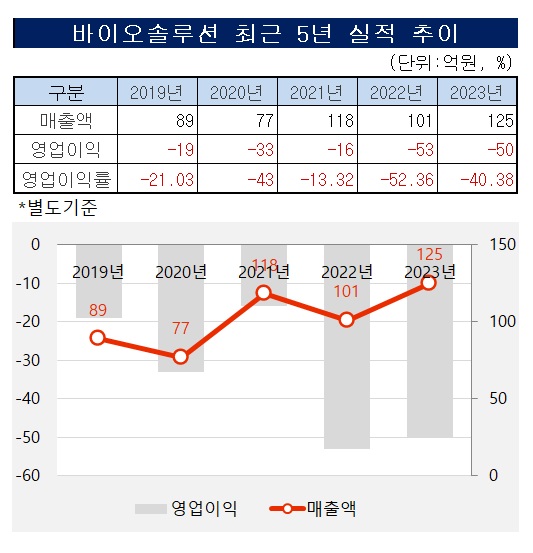
3월 말 기준 바이오솔루션이 보유한 현금성 자산은 85억원에 불과하다. 3개월 새 차입금 상환과 영업손실 상계 등으로 535억원을 투입한 결과다.
이 때문에 일각에선 바이오솔루션이 재무구조 개선을 위해 일부 파이프라인을 정리할 것으로 분석했다. 실제 지난해 전체 매출액 대비 R&D 비용 비율을 53.31%에 달했다. 올해 1분기엔 이미 작년의 절반 수준의 R&D 비용을 지출했다. 1분기 매출액 대비 R&D 비용 집행 비율은 90%를 넘는다.
특히 연골치료제의 경우 카티로이드보다 앞선 파이프라인인 카티라이프를 보유하고 있다. 계열 내 최초(first in class) 신약인 무릎연골재생 세포치료제 '카티라이프'는 이미 국내에서 임상 3상, 미국에서 임상 2상이 진행중이다.
최근 1차 유효성 평가(48주) 결과 유효성을 입증하기도 했다. 무릎 관절연골 결손이 있는 대상자 104명을 대상으로 카티라이프 이식과 미세천공술 간 치료 효능 관련 비교·평가를 진행했다. 특히 50대 이상 골관절염 환자에게서도 연골 재생 효과를 확인하기도 했다.
이에 대해 장 대표는 "올해 흑자전환을 목표로하고 있고 이에 대한 대책도 강구하고 있다"면서도 "인위적인 파이프라인 정리는 생각하지 않고 있다"며 "카티로이드 역시 상용화가 가능한 핵심 파이프라인인 만큼 임상 진행은 물론 지속적으로 개발하겠다"고 강조했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- [i-point]대동, 로드쇼·박람회 체험 마케팅으로 튀르키예 공략
- [i-point]아이티센, 도쿄증권거래소 상장 목표 JPYC와 MOU
- [i-point]빛과전자, 비츠로시스와 인도네시아 통신사업 확대 MOU
- [i-point]케이웨더, 공기통합관제시스템 보급 확대 본격화
- [SEDEX 2024] 삼성전자, GAA 기술 적용한 4F스퀘어 D램 개발
- 라온시큐어-이데링크, e-포트폴리오로 대학생 취업 지원
- [SEDEX 2024] LX세미콘, 디스플레이 의존도 축소 키워드 '자동차'
- [SK스퀘어 밸류업 구상 점검] SK플래닛, '다사다난' 변천사…OK캐쉬백 중심 재편
- [막 오른 국산 P-CAB 도전기]케이캡 공신 종근당 잡은 대웅제약, 실적 보여준 파급력
- [SG헬스케어 IPO In-depth]연이은 정정신고에 스팩주가 '널뛰기', 혼란스러운 투자자
김형석 기자의 다른 기사 보기
-
- [2024 제약·바이오 컨퍼런스]"글로벌 트렌드에 기민해야, 역시 대세는 항암·비만·CNS"
- 금감원, 오름테라퓨틱 신고서 정정요구…상장지연 불가피
- 펩트론 주가 급증 덕본 최호일 대표, '유증·블록딜' 활용법
- [Policy Radar]국내 주요기업 참전한 최대 유전체 정부사업, 23일 결론
- [2024 이사회 평가]한진칼, 이사진 '평가·개선안' 부실…CEO 승계정책도 미비
- [루키 바이오텍 in market]넉넉한 현금 확보한 엔솔바이오, 지속성 첫 단추 '상장'
- [2024 이사회 평가]한진칼, 사외이사 8인 '과반 이상'…경영 '견제기능' 방점
- [2024 이사회 평가]한진칼, '정보접근성·구성' 우수…내부 평가 제도는 과제
- [루키 바이오텍 in market]엔솔바이오, 탄탄한 'P2K' 기술…상장고배 후 빠른 재도전
- 대원제약, 출시 13년 된 의약품 인수…매출·R&D 확장 전략

























