[K-바이오 안질환 치료제 줌인]HLB테라, 임상 고배 '안구건조증' 연기…각막염으로 선회⑤3상 3건 중 1건만 성공…'미국·EU'서 각막염 최종 3상 추진
김진호 기자공개 2025-03-04 08:36:06
[편집자주]
고령화로 인한 망막질환이나 스마트 기기의 잦은 사용으로 발생하는 안구건조증. 안과(안)질환 치료제 시장이 급성장하는 추세다. 그러나 눈에 주입하는 주사제나 점안제 정도의 치료제 외 이렇다 할 치료제가 나오지 않고 있다. 일부 질환에서 투약 편의성을 높일 경구제 개발 시도가 있었지만 결실을 맺지 못했다. 이처럼 난이도가 높은 안질환 치료제에 도전장을 내민 K-바이오텍을 더벨이 들여다봤다.
이 기사는 2025년 02월 28일 07시57분 thebell에 표출된 기사입니다
HLB테라퓨틱스는 미국 종속회사인 '리젠트리(ReGenTree)'를 통해 안질환 신약을 개발하고 있다. 선도 파이프라인 'RGN-259'에 대해 미국에서 안구건조증 관련 임상 3건을 마무리했다. 그러나 1건만 성공했다. 규정상 1건의 임상 3상을 더 성공해야 허가 신청을 시도할 수 있다. 개발 여력 상 관련 절차를 잠시 미뤄둔 상태다.대신 신경영양성각막염(NK·각막염) 관련 3상을 미국과 유럽 연합(EU)에서 동시에 진행하는 데 힘을 쏟는 중이다. 늦어도 내년에는 주요국에서 허가 신청을 완료하는 것을 목표로 하고 있다.
◇안구건조증 임상 3건 중 1건만 성공, 추가 개발은 잠정 연기
HLB테라퓨틱스의 자회사 리젠트리는 2015년 파트너사인 미국 '리제넥스'와 합작해 설립했다. 작년 3분기 기준 HLB테라퓨틱스가 보유한 리젠트리 의결권은 전체의 70%로 사실상 신약개발 사업 전반을 지휘하고 있다고 볼 수 있다.
리젠트리가 보유한 파이프라인 RGN-259는 '티모신베타4(Tβ4)'를 억제하는 항염증 신약 후보물질이다. 염증이나 상처 등 복잡한 원인으로 발생하는 안구건조증과 각막염 등 여러 안질환의 증상을 완화할 가능성이 있는 기전이라는 평가다.
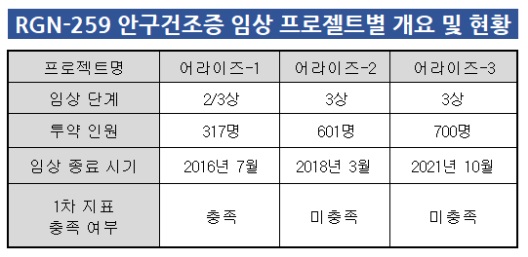
미국 클리니컬 트라이얼에 따르면 RGN-259에 대한 안구건조증 관련 3건의 임상 3상이 이미 종료됐다. 프로젝트명은 '어라이즈(ARISE)-1'부터 2, 3 등이었다.
어라이즈-1은 317명을 대상으로 진행한 임상 2/3상이며 2015년에 끝났다. 각막형광염색점수(CFSS)와 안구불편점수(ODS) 등이 1차 지표였으며 눈물량 측정에 쓰는 셔머테스트나 안구표면질환지수 등이 2차 지표였다. 어라이즈-2는 601명을 대상으로 2018년에, 어라이즈-3은 700명을 대상으로 2021년에 마무리됐다.
성공은 어라이즈-1 뿐이었다. 나머지 2건은 실패로 돌아갔다. 미국의 안구건조증 신약 가이드라인 중 최소 2건의 임상 3상에서 설정한 지표별 유효성을 확보해야 허가 신청을 낼 수 있다. 결국 RGN-259의 허가 신청을 시도하려면 적어도 1건의 임상 3상을 추가로 진행해 성공해야 한다.
HLB테라퓨틱스 관계자는 "RGN-259의 안구건조증 추가 3상은 잠정적으로 미룬 상태"라고 말했다.
◇미국은 두 번째, EU서 첫 각막염 3상 동시 진행…연내 종료 예고
HLB테라퓨틱스는 안구건조증 대신 확실한 염증질환으로 분류되는 각막염 적응증으로 전략을 선회했다. 미국과 EU에서 RGN-259의 각막염 임상 3상을 병행하는 이유다.
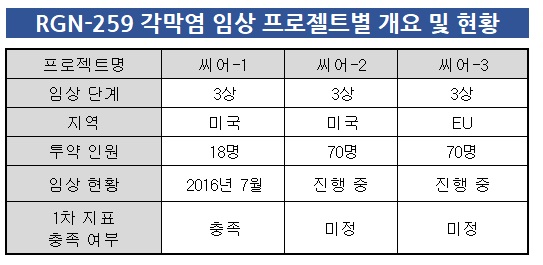
각막염 관련한 미국 임상 3상은 이미 완료된 '씨어(SEER)-1'과 현재 진행 중인 씨어-2 등 2건이다. 안구건조증과 마찬가지로 미국에서는 2건 이상의 임상 3상을 완료해야 허가 신청을 할 수 있다.
씨어-1은 18명을 대상으로 2015년에 개시해 2020년에 완료됐다. 참여자 중 10명은 RGN-259투약군, 8명은 위약군에 포함됐다. 일회용 점안제 방식으로 투약 후 4주 경과시점에서 완전히 치료된 환자 비율이 1차 지표였다. 당시 RGN-259 투약군은 6명, 위약군은 1명씩 완전히 치료된 것으로 나타났다.
씨어-2는 2023년 4월 개시했고 목표 인원인 70명을 채우고자 환자 모집 절차를 밟는 중이다. 씨어-1과 1차 지표가 같으며 완료 예상 시점은 올해 하반기다.
당초 작년 11월 투약까지 완료된 예정이었지만 경쟁약물인 '옥서베이트'로 인해 환자 모집이 다소 지연되고 있다. 반면 EU에서 진행되는 씨어-3는 미국과 같은 수로 설정한 환자 모집이 마무리됐다. 연내 결과 발표를 예고하고 있다.
HLB테라퓨틱스는 미국과 달리 EU에서는 1건의 임상 3상만 성공해도 허가 신청이 가능한 것으로 파악하고 있다. 타임라인상 이르면 연내, 늦어도 내년에는 EU와 미국 순으로 각막염 관련 RGN-259의 허가 신청서를 제출하는 것을 목표로 내걸고 있다.
HLB테라퓨틱스 관계자는 "씨어-2와 씨어-3 등이 성공적으로 완료되면 주요국에서 허가 절차를 밟게될 것"이라며 "빅파마가 실사를 진행하는 등 RGN-259를 기술수출하려는 논의도 진행되고 있다"고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- [주주총회 프리뷰]한화엔진, 그룹 지원받고 운송효율 높인다
- [On the move]'IPO 기대주' LS엠앤엠, 이차전지 인재확보 속도
- [이사회 모니터]SK그룹 '리밸런싱' 키맨 강동수 이노베이션 부사장 합류
- [토종 AI 반도체 생태계 점검]퓨리오사AI, 자금 조달 벽에 막힌 기술력
- '젝시믹스' 브랜드엑스코퍼, 3000억 매출 보인다
- [thebell interview/봄바람 부는 크립토 B2B]조진석 KODA 대표 "기관 중심 주주 투명성, 경쟁력 핵심"
- [thebell interview/봄바람 부는 크립토 B2B]김민수 KDAC 대표 "스테이블코인 주목, 도전 준비 중"
- [i-point]대동, 2025년 대리점 연전시 개최
- [i-point]신성이엔지, '인터배터리 2025' 첨단 드라이룸 기술 공개
- [탈한한령 훈풍 부는 콘텐츠기업들]디어유, 텐센트뮤직과 손잡고 중국시장 '정면 돌파'
김진호 기자의 다른 기사 보기
-
- 엑셀세라퓨틱스 'MSC 배지' 미국 원료 인정에 신약도 등장
- [K-바이오 안질환 치료제 줌인]HLB테라, 임상 고배 '안구건조증' 연기…각막염으로 선회
- [K-바이오 안질환 치료제 줌인]한올바이오, 안구건조 세번째 도전 '허가까지 최소 5년'
- 쎌바이오텍, 힘 싣는 가족경영…창업주 딸 2인 '사내이사'
- 비보존제약 어나프라주 생산, 갑작스런 '생크션' 고민
- [K-바이오 안질환 치료제 줌인]질환 셋 '동시개발' 와이디생명…3상 진입한 안지오랩
- [K-바이오 안질환 치료제 줌인]큐라클, 이유있는 후기임상 도전 '경구제 시력개선' 유일
- 아리바이오 치매약 'AR1001' 미국 3상 환자 등록 완료
- 롯데바이오의 '솔루플렉스 링크', 오작동률 최소화 무기
- [K-바이오 안질환 치료제 줌인]효과 입증 난제에 혁신 신약 부재…'수십조 시장' 잡아라
























