[오가노이드사이언스 IPO]임상 성공 전제한 공모가 산출…발도 못 뗀 상업화 임상ATORM-C ‘첨생’ 임상 머물러, 식약처 IND 승인 아직…L/O 상업화 임상 ‘선결’돼야
김성아 기자공개 2025-01-23 09:31:15
이 기사는 2025년 01월 22일 08시09분 thebell에 표출된 기사입니다
오가노이드사이언스는 국내 최초 '오가노이드 재생치료제' 기술 기업이라는 이름으로 기업공개(IPO)에 나섰다. 초기 기술이라는 우려에도 한국거래소 설득에 성공하면서 예비심사 승인이라는 IPO 8부 능선을 넘었다.하지만 여전히 증명해야 할 부분이 많다. 특히 희망 공모가 산출 과정에서 아직 상업화 임상에도 진입하지 않은 파이프라인의 기술이전과 상업화 매출을 포함시켰다는 점이 눈길이 간다.
최근 매출 추정치에 대한 금융당국의 잣대가 높아진데 따라 사업화 및 지속성에 대한 입증 부담이 가중될 수 밖에 없다. 그럼에도 오가노이드사이언스는 언론 접촉 등을 줄이면서 소통에 소극적인 모습을 보이고 있다.
◇신약 매출 발생 시기 앞당긴 첨생법, 2027년부터 ATORM-C 매출
오가노이드사이언스는 작년 말 예심 승인 이후 한 달 만인 이달 초 증권신고서를 제출했다. 오가노이드 재생치료제 기술 기업으로는 처음 시장에 등장하는 만큼 재생치료제 후보물질 ‘ATORM-C’의 첫 매출 발생 시기에 관심이 모였다.
추정 연결손익계산서에 따르면 ATORM-C 관련 매출은 2027년 처음 발생한다. 수익 유형은 ‘첨단재생바이오법’으로 약 47억원의 매출을 올릴 전망이다. 해당연도 추정 매출액의 16%에 해당한다.
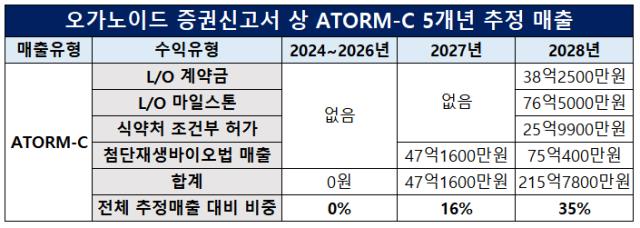
첨단재생바이오법 매출은 2월부터 시행되는 첨생법 개정안에 따른 부분이다. 개정안에 따라 첨단바이오의약품 임상을 마치면 해당 의약품에 대해 치료사용승인을 신청할 수 있다. 승인 시 환자들에게 돈을 받고 의약품을 판매할 수 있게 된다.
이 때문에 오가노이드사이언스는 ATORM-C가 아직 첨단재생의료 임상 단계에 머물러있음에도 불구하고 2년 뒤인 2027년부터 매출을 낼 수 있을 것으로 추정했다.
하지만 제한적인 부분은 있다. 첨단바이오의약품 치료 사용은 연간 투여 환자 수와 청구 비용이 제한돼있어 일정 이상 매출을 내기 어렵다. 또 5년마다 재심의를 받아야 해 매출 영속성에 대한 리스크가 있다.
◇기술이전 가능성 논의 ‘시기상조’ 식약처 IND 승인은 나야
오가노이드사이언스는 첨생법으로 ATORM-C의 매출을 내기 시작한 2027년 이듬해인 2028년기술이전 수익과 실제 상업화 수익을 추정 매출에 더했다. 해당연도 ATORM-C 관련 추정 매출액은 216억원으로 전체 매출액의 35%에 해당한다.
2028년 추정 매출액을 기반으로 산정한 당기순이익은 희망공모가액 산출에 반영됐다. 오가노이드사이언스는 ATORM-C의 기술이전을 통해 본격적인 이익 성장이 이뤄지는 시점인 2028년 당기순이익에 기반해 기업가치를 평가하는 것이 타당할 것으로 판단했다고 밝혔다.
하지만 2028년 ATORM-C 매출 구성요소 중 첨생법 매출을 제외한 기술이전과 식약처 허가 이후 상업화 매출은 근거가 빈약하다는 시각이 제기됐다. 기술이전과 상업화의 선결조건인 규제당국의 상업화 임상시험계획(IND) 승인을 아직 받지 못했기 때문이다.
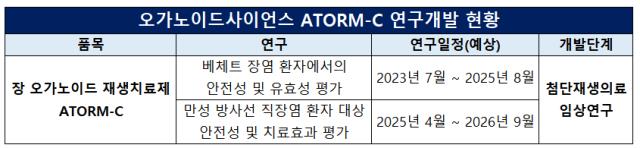
오가노이드사이언스는 ATORM-C의 미국과 유럽 글로벌 임상 2상을 마친 후 기술이전을 진행할 계획이라고 밝혔다. 하지만 현재 ATORM-C는 베체트 장염과 만성 방사선 직장염에 대한 첨단재생의료 임상연구만을 진행하고 있을 뿐 국내외 규제당국 어느 곳에서도 IND 승인을 받지 못했다.
바이오 업계 관계자는 “최근 대부분의 기술이전이 후보물질 단계보다 규제당국으로부터 승인 받은 상업화 임상 데이터를 바탕으로 진행되는 추세”라며 “오가노이드와 같이 초기기술의 경우 파트너사 설득을 위해서 더욱 상업화 임상 데이터가 필요할 것”이라고 설명했다.
오가노이드사이언스는 ATORM-C에 대한 임상 1상 IND를 지난해 4월 신청했으나 12월 식약처로부터 보완 지시를 받았다. 이에 추가 실험을 완료한 뒤 올해 상반기 중 IND를 다시 제출할 계획이다.
만약 IND 승인이 연내 이뤄진다고 하더라도 식약처의 상업화 조건부 허가 조건인 2상을 3년 내 완료하기에는 시간이 촉박하다. 환자 모집이 쉽지 않기 때문이다.
현재 진행 중인 첨단재생의료 임상 역시 2023년 5월부터 환자 등록을 시작했음에도 불구하고 아직까지 2명의 환자에 대해서만 투여 후 추적관찰을 시작했다. 오가노이드사이언스는 어려운 환자 모집 상황에 임상 종료 시기를 맞추기 위해 임상 규모를 8명에서 5명으로 변경하는 것을 고려 중이다.
후기 임상에 대한 리스크는 기술평가를 진행한 평가기관에 의견서에서도 드러났다. BBB등급을 매긴 한 평가기관은 “재생치료제의 후속 임상개발에서의 높은 위험성에 반해 이에 대한 리스크 관리가 충분히 이루어지지 않았다”고 명기하기도 했다.
더벨은 ATORM-C 상업화 임상 진척 상황과 기술이전 가능성 등에 대한 입장을 듣기 위해 오가노이드사이언스와 접촉을 시도했으나 연락이 닿지 않았다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 인더스트리
-
- [i-point]빛과전자, 미국 데이터센터 시장 영업 확대
- [i-point]제이엘케이, 2025 국제뇌졸중컨퍼런스 참가
- [i-point]유하푸른재단, 제 8기 장학생 선발·수여식 개최
- [i-point]대동그룹, 2024 핀업 디자인 어워드 3관왕 달성
- [i-point]라온시큐어 "설 명절 앞두고 피싱 기승“
- 아로마티카, RCPS 전액 보통주 전환…4월 예심청구 예고
- [포스트 망분리 시대 개막]SGA솔루션즈, 클라우드·제로 트러스트 투자 '반신반의'
- 박셀바이오, '영속성' 확보 전략 'M&A'…석달새 두건 인수
- [Policy Radar]저성과 기업 상폐에 속도, 바이오텍 시총 관리 관건
- [thebell interview]인벤티지랩의 퀀텀점프, 주사제 GMP 구축 그리고 'LNP'
김성아 기자의 다른 기사 보기
-
- 아로마티카, RCPS 전액 보통주 전환…4월 예심청구 예고
- 박셀바이오, '영속성' 확보 전략 'M&A'…석달새 두건 인수
- [오가노이드사이언스 IPO]임상 성공 전제한 공모가 산출…발도 못 뗀 상업화 임상
- 매출 4조 벽 뚫은 삼성바이오, 올해 25% 성장 '5.6조' 예고
- [오름테라퓨틱 IPO]달라진 IR 전략, 시장 '친화·소통’ 기조에 투자자들 '반색'
- [인투셀 IPO]비교군 오름테라퓨틱 감안 '2000억' 시총 "밸류 더 높일것"
- 코스닥도 ADC 열풍, 2025년 바이오 IPO ‘오름·인투셀’ 포문
- 삼성바이오에피스, 김경아 대표 취임 후 R&D 조직 바꿨다
- CJ바이오사이언스, 이유있는 B2C 진출 '법차손·매출' 부담
- [오름테라퓨틱 IPO]"연구개발비는 못 건든다" 줄어든 공모액에 인건비 ‘싹둑’




















