[제약바이오 시총분석]HLB, 간암 치료제 생동시험 자진공개...시총 4000억 상승NDA 일정 공개, 위암 단독 임상 반면교사 삼아 속도전…선낭암 등 새 적응증 확장도 '잰걸음'
최은수 기자공개 2023-01-11 12:52:58
[편집자주]
시가총액이 반드시 기업가치를 대변하는 건 아니다. 신약개발에 도전하는 바이오업체일수록 더욱 그렇다. 하지만 시가총액은 제약바이오산업의 상황을 보여주는 좋은 잣대가 되기도 한다. 임상 결과나 기술이전(라이선스아웃) 등이 빠르게 반영되고 시장 상황도 고스란히 반영되기 때문이다. 코스닥에 상장된 상위 20개 제약바이오 회사의 시가총액 추이를 통해 제약바이오 산업의 이슈와 자본시장의 흐름을 짚어본다.
이 기사는 2023년 01월 09일 14시58분 thebell에 표출된 기사입니다
핵심 파이프라인 리보세라닙(Rivoceranib)의 미국 시장 진입을 노리는 HLB가 간암 1차 치료제 신약승인신청(New Drug Application, NDA)을 위한 진행상황을 공개하며 몸값을 끌어올렸다.회사는 앞서 임상을 종료한 위암 적응증 리보세라닙 단독 임상의 경우 출시 절차와 사후 시장 포지셔닝 등의 문제로 임상 일부 지연이 있었다. 다만 간암 병용(리보세라닙+캄렐리주맙) 임상은 만족스러운 데이터와 파트너사와의 협업을 앞세워 속도전에 나서는 모습이다.
◇병용임상 생동시험 마치며 NDA 제출 첫발… 시장 기대감 빠르게 대응
HLB는 최근 글로벌 간암 1차 치료제 임상을 모두 마치고 신약허가신청(NDA)의 첫 작업인 생물학적동등성 시험(bioequivalence test, 생동)을 진행한 사실을 공개했다. 해당 시험은 HLB의 자회사 엘레바와 중국 캄렐리주맙 개발사이자 이번 임상 파트너사 항서제약에서 각각 제조된 리보세라닙 정제가 서로 동등한지 여부를 판단하기 위해 시행됐다.
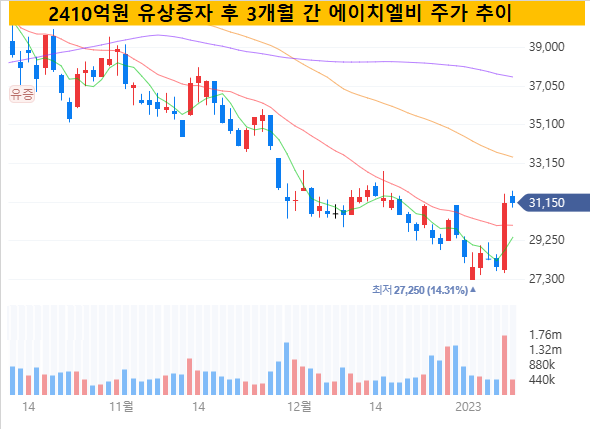
HLB가 생동시험을 포함한 간암 1차 치료제로의 승인 작업 일정을 공개하자 시장은 이를 호재로 해석했다. 작년 말 3조2000억원으로 한해를 마감한 에이치엘비는 9일 현재 3조6220억원 대의 시가총액을 기록 중이다.
한때 4조원을 넘었던 HLB의 시가총액은 작년 10월 2410억원 규모의 주주배정 유상증자를 기점으로 이후 줄곧 감소했다. 작년 말엔 3조원 대 몸값을 위협받기도 했는데 이번 생동시험 이슈에 힘입어 지난 한 주 동안 4000억원 가량의 시총을 회복한 모습이다.
일반적으로 생동시험의 경우 공시 대상이거나 공개 의무 사안에 해당하지 않는다. 다만 회사 측은 임상목적으로 제조된 리보세라닙과 향후 상업용 리보세라닙의 차이점이 없는지를 밝히는 것은 NDA 제출을 위한 중요한 이정표로 보고 이 과정을 시장에 공개했다.
과거 진행했던 위암 단독 임상 건과 달리 간암 임상에 대한 세부 일정을 시장에 적극적으로 공개하는 모습이다. 간암에 앞서 단독임상으로 진행했던 위암 3·4차 치료제(임상명 'Angel') NDA 작업은 임상이 종료된 후 3년 간 리뷰가 활발하게 진행되지 않았던 것과 차이점을 보인다.
◇긍정적 임상 토대 NDA 속도전…선낭암·위암 등 단독 임상도 '잰걸음'
HLB가 NDA 일정을 시장에 상세히 공개하기 시작한 배경은 긍정적인 임상 데이터가 뒷받침되기 때문으로 풀이된다. 2019년 위암 3·4차 치료제로서의 리보세라닙 글로벌 단독 임상의 경우 통계학적 유의미성 도달에 실패하면서 교착상태에 들어섰다.
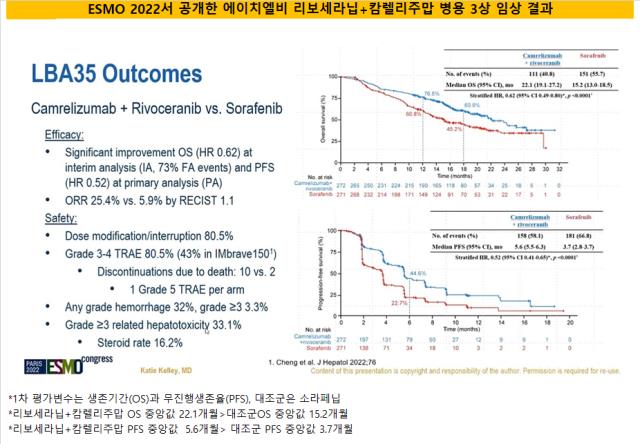
간암 임상의 경우 임상 데이터를 통해 여러 통계적 유의성을 입증한 상태다. 회사는 해당 병용 임상 3상의 핵심(1차) 유효성지표를 전체생존기간 중앙값(mOS)으로 잡았다. 해당 임상의 mOS는 22.1개월로 임상 대조군(소라페닙 투여군, 15.2개월) 대비 7개월 가량 길었다.
기타 지표 또한 대조군 대비 높은 효능을 입증했다. 리보세라닙+캄렐리주맙의 무진행생존기간 중앙값(mPFS)은 5.6개월로 대조군 2개월 가량 높았고 객관적반응률(ORR)도 20% 포인트 가량 높았다. 질병통제율(DCR)은 소라페닙(53.9%) 대비 25% 포인트 높은 것으로 나타났다.
리보세라닙 단독 임상의 경우 위암 외에도 선낭암 프로그램을 가동중이다. 다만 단독 임상은 FDA 인허가 규정상 임상 및 NDA 작업을 동시에 진행할 수 없다. 이에 따라 위암 3·4차 치료제의 NDA에 나서 가부를 확인하거나 현재 2상 중인 선낭암의 임상을 심화해 3상에 들어설 것으로 전망된다.
에이치엘비 관계자는 "선낭암 단독임상의 경우 FDA와 소통하며 투여 용량의 적합성을 보강하기 위한 분석(Modeling & Simulation) 절차를 진행중이며 수개월 내 관련 결과를 토대로 임상 확장에 나설 계획"이라며 "위암 단독임상 건 역시 FDA와 지속적으로 데이터 및 문서를 주고 받고 있다"고 말했다.
한편 리보세라닙은 저분자화합물(small molecule)의 경구용 제제다. 신생혈관생성 수용체(VEGFR-2)를 억제하는 기전이며 항체 의약품이나 세포치료제 등과 비교해 복용편의성이 높고 대량생산 등이 유리한 부분이 강점이다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
best clicks
최신뉴스 in 전체기사
-
- [i-point]인텔렉추얼디스커버리, 원트랜스폼과 파트너쉽 체결
- hy, 계절 맞춘 '잇츠온 박속 연포탕' 신제품 출시
- 'e빔 전문' 쎄크, 수요예측 흥행...IPO 공모가 최상단 확정
- [i-point]미래아이앤지, 수협은행에 'SWIFT ISO20022' 솔루션 공급
- 넥슨 '카잔' 흥행 비결은 '보스전·최적화·소통'
- [WM 풍향계]"금 팔까요? 살까요?" 엇갈리는 문의 급증
- 오라이언 이성엽, '메자닌' 안목 적중…코벤 성과 눈길
- 제일엠앤에스, CB 투자 운용사 어쩌나
- [2025 주총 행동주의 리포트]표대결 아닌 설득에 초점…트러스톤 '대화형 주주행동'
- 연금 통합한 우리은행 WM그룹, 컨설팅 파트 간판 바꾼다
최은수 기자의 다른 기사 보기
-
- [ROE 분석]삼성화재, 자본감소 최소화하며 효익은 최대로
- [밸류업 성과 평가]10대 그룹 참여도 LG·HD현대 으뜸 한화·GS는 불참
- [밸류업 성과 평가]삼성그룹의 저조한 참여, 계열사 중 삼성화재만
- [밸류업 성과 평가]바이오·헬스 부문 밸류업 참여 다수…엘앤씨바이오 톱
- [밸류업 성과 평가]'FDA 넘은 항암제' 유한양행, 코스피 바이오·헬스 으뜸
- [ROE 분석]두자릿수 이익률 낸 손해보험사 'IFRS17·K-ICS가 기회'
- [ROE 분석]생존 기로 선 중소형 생보사, '이익률' 제고 관건
- [밸류업 성과 평가]건설·부동산 업종 현대건설 뿐, '생존'이 급선무
- [ROE 분석]교보생명, '전략'이 만든 역대 최대 자기자본이익률
- [ROE 분석]한화생명, 빅3 중 가장 낮은 이익률 상승세
























