[thebell interview]국산 CAR-T '안발셀' 의료진 효능인정, 상용화 잰걸음김건수 큐로셀 대표 "2상 통계적 유의성 확보…허가 후 적응증 확대 추진"
정새임 기자공개 2024-03-11 07:55:00
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2024년 03월 08일 08시20분 thebell에 표출된 기사입니다
최초의 국산 CAR-T 개발을 꿈꾸는 큐로셀이 '안발셀' 2상 톱라인 데이터를 공개했다. 완전관해율 67%를 포함한 객관적 반응률(ORR) 75%이다. 국내에서 사용되고 있는 경쟁 CAR-T 제품을 능가하는 긍정적인 결과다.안발셀은 후발주자이지만 효능과 가격, 제조기간 등에서 충분한 장점을 발휘할 것으로 점쳐진다. 더벨은 김건수 큐로셀 대표(사진)를 통해 안발셀 허가임상 결과의 의미를 들었다.
◇10명 중 7명 유효반응, 완전관해 67% 쾌거
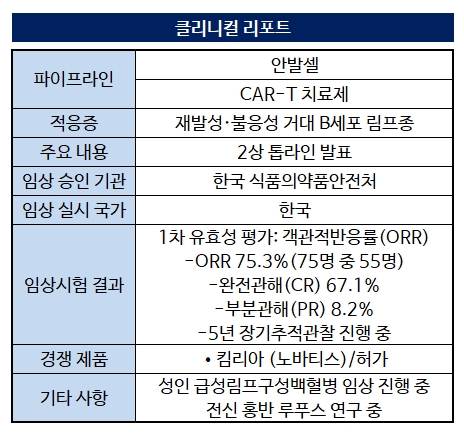
 큐로셀은 7일 CAR-T 치료제 안발셀의 국내 2상 임상시험 톱라인 결과를 발표했다. 혈액암 중 하나인 재발성·불응성 거대 B세포 림프종 환자 79명을 대상으로 한 결과 안발셀은 통계적 유의성을 충족했다.
큐로셀은 7일 CAR-T 치료제 안발셀의 국내 2상 임상시험 톱라인 결과를 발표했다. 혈액암 중 하나인 재발성·불응성 거대 B세포 림프종 환자 79명을 대상으로 한 결과 안발셀은 통계적 유의성을 충족했다.2상의 1차 유효성 평가변수는 객관적 반응률이다. 유효성 분석에 포함된 73명 중 55명(75.3%)에서 유효한 반응을 보였다. 이 중 67.1%는 완전관해(종양이 완전히 사라진 상태)를 기록했다. 부분반응은 8.2%였다.
안발셀 2상은 대조군이 없는 임상으로 통계적 기법에 따라 신뢰구간 하한이 20%보다 크면 안발셀 유효성을 입증했다고 판단한다. 분석 결과 안발셀의 반응률이 통계적 유의성을 확인했다는 설명이다.
김 대표는 더벨과의 전화 인터뷰에서 "경쟁약과 헤드 투 헤드(head-to-head) 임상이 아니어서 직접적인 비교를 할 수 없지만 완전관해 등 반응률이 여타 치료제보다 좋게 나왔다는 사실을 고무적으로 보고 있다"고 말했다.
1차 중간평가 때보다 모수가 많아지면서 데이터 조정이 있었지만 그럼에도 우수한 효능을 입증했다는 설명이다.
이는 안발셀이 국내 품목허가에 한발짝 더 다가갔다는 의미이기도 하다. 안발셀의 경우 2상 데이터로 품목허가를 신청할 수 있다.
오는 하반기 식품의약품안전처에 안발셀 허가를 신청할 계획이다. 내년 결과를 받을 수 있을 것으로 기대된다.
김 대표는 "비임상 단계부터 식약처와 긴밀히 소통해왔고 2상 데이터를 정리해 빠르게 품목허가를 신청할 계획"이라고 덧붙였다.
◇효능·가격·제조기간서 '경쟁력' 확보…허가 후 영역 넓힌다
안발셀은 국산 최초의 CAR-T 치료제로 비슷한 적응증을 지닌 경쟁약으로는 노바티스의 '킴리아'가 있다. 킴리아는 지난 2022년 4월 건강보험 급여 인정을 받아 △두 가지 이상의 전신 치료 후 재발성 또는 불응성인 성인 미만성 거대 B세포 림프종 △25세 이하의 소아 및 젊은 성인 환자에서 이식 후 재발 또는 2차 재발 및 이후의 재발 또는 불응성 B세포 급성 림프성 백혈병에서 쓰이고 있다.
첫 번째는 단연 약효다. 기존 CAR-T를 사용하던 의료진들이 안발셀 임상에 참여했는데 환자에서 높은 반응과 우수한 종양제거능력을 인정했다는 후문이다.
김 대표는 "안발셀의 가장 강력한 경쟁력은 약효"라며 "안발셀을 통해 얻을 수 있는 의학적 베네핏에서 안발셀이 가장 확률이 높고 의료진의 선택을 받을 수 있으리라 생각한다"고 자신했다.
안발셀의 또 다른 강점은 짧은 제조기간이다. CAR-T는 맞춤형 치료제로 환자에 바로 약을 투여할 수 없다. 환자의 혈액을 채취해 제조소에서 유전자 조작을 거친 뒤 환자에게 다시 배송된다. 특히 외국 약인 킴리아는 제조소가 해외에 있어 약이 오고가는데 긴 시간이 걸린다. 킴리아의 제조 기간은 30~40일 정도로 알려졌다.
큐로셀은 CAR-T 제조를 최대한 줄일 수 있도록 품질검사 신속검사법을 개발하고 대전에 자체 제조시설도 마련했다. 채취부터 투약까지 걸리는 기간을 16일로 기존보다 두 배 이상 단축했다.
더불어 기존 치료제보다 더 저렴한 약가를 고려하고 있어 허가 시 급여 등재도 수월할 것으로 전망된다. 킴리아의 국내 약가는 약 3억6000만원에 달한다.
큐로셀은 빠른 상용화 전략으로 안발셀의 국내 허가를 받은 후 적응증을 넓혀가는 동시에 해외 시장도 공략할 계획이다.
김 대표는 "림프종보다 환자수가 훨씬 많은 전신 홍반성 루푸스 등 안발셀의 새로운 적응증을 타깃하는 동시에 해외 진출에도 속도를 높일 것"이라며 "일본 등 아시아 지역을 우선으로 안발셀의 영역을 넓혀갈 계획"이라고 말했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- 청약증거금 2조 몰린 쎄크, 공모청약 흥행 '28일 상장'
- [영상/Red&Blue]겹경사 대한항공, 아쉬운 주가
- [i-point]모아라이프플러스, 충북대학교와 공동연구 협약 체결
- [i-point]폴라리스오피스, KT클라우드 ‘AI Foundry' 파트너로 참여
- [i-point]고영, 용인시와 지연역계 진로교육 업무협약
- [i-point]DS단석, 1분기 매출·영업이익 동반 성장
- [피스피스스튜디오 IPO]안정적 지배구조, 공모 부담요소 줄였다
- 한국은행, 관세 전쟁에 손발 묶였다…5월에 쏠리는 눈
- [보험사 CSM 점검]현대해상, 가정 변경 충격 속 뚜렷한 신계약 '질적 성과'
- [8대 카드사 지각변동]신한카드, 굳건한 비카드 강자…롯데·BC 성장세 주목
정새임 기자의 다른 기사 보기
-
- 성숙기 접어든 KDDF, 지원과제 늘리고 투자유치 스퍼트
- [AACR 2025 프리뷰]신약 개발 속도내는 제이인츠바이오, 연구 2건 출격
- [AACR 2025 프리뷰]국내 항암 신약 투톱 유한양행·한미약품, '최다' 기록 쓴다
- [AACR 2025 프리뷰]항암 신약 글로벌 진출 필수 관문, 커지는 K-바이오 존재감
- [이뮨온시아 IPO]의사에서 경영자로, '국산 항암 신약' 비전으로 뭉친 '원팀'
- "BBT-877 적응증 재탐색" 대응 나선 브릿지바이오
- [인투셀 IPO]상장 주관사에 후한 보상, 10% 신주인수권 별도 지급
- 브릿지바이오, 'BBT-877' 유효성 불발…멀어진 기술이전
- [이뮨온시아 IPO]기술이전 기반 시총 2000억 겨냥, 기댈 구석 'IMC-002'
- [thebell note]달라지는 제약사 주총
























