[클리니컬 리포트]'골다공증 라인업 확장' 셀트리온, 관건은 '속도·특허협의'CT-P41로 연 매출 8조 시장 정조준…시밀러 간 경쟁, 원개발사 방패막 촉각
차지현 기자공개 2024-08-08 09:03:21
[편집자주]
혁신신약을 노리는 기대주, 즉 파이프라인에 대한 가치 평가는 어렵다. 품목허가를 너머 성공적인 상업화에 도달하기까진 임상 평가 지표 외에도 시장 상황, 경쟁사 현황, 인허가 과정이 얽혀 있다. 각사가 내놓는 임상(Clinical) 자체 결과는 물론 비정형화한 데이터를 꼼꼼히 살펴야 하는 이유가 여기에 있다. 국내 주요 제약사와 바이오텍의 주력 파이프라인을 해부해 본다.
이 기사는 2024년 08월 06일 11:01 thebell 에 표출된 기사입니다.
2030년까지 바이오시밀러 제품을 22종까지 늘리겠다고 공언한 셀트리온. 최근 포트폴리오를 확장에 속도를 내고 있다. 주요 국가 허가 절차를 밟고 있는 골다공증 치료제 바이오시밀러의 임상 3상 결과를 국제 저널에 공개했다.글로벌 연 매출 5조원에 육박하는 블록버스터 의약품 시장을 공략한다는 점에서 주목을 받는다. 경쟁이 치열해진 환경과 까다로운 특허 장벽 등은 넘어야 할 관문으로 꼽힌다.
◇오리지널과 동등성 입증…국내·미국·유럽서 허가 진행 중
셀트리온은 국제골다공증재단(IOF)과 뼈건강및골다공증재단(BHOF) 공식 저널인 '국제 골다공증'을 통해 암젠의 골다공증 치료제 프롤리아 바이오시밀러 바이오시밀러 'CT-P41'의 다국가 임상 3상 결과를 게재했다고 6일 밝혔다.
앞서 유럽 4개국에서 폐경 후 골다공증이 있는 여성 환자 479명을 대상으로 임상 3상을 진행, CT-P41과 오리지널 의약품 간 유효성, 약력학, 약동학 및 면역원성을 포함한 안전성을 비교했다.
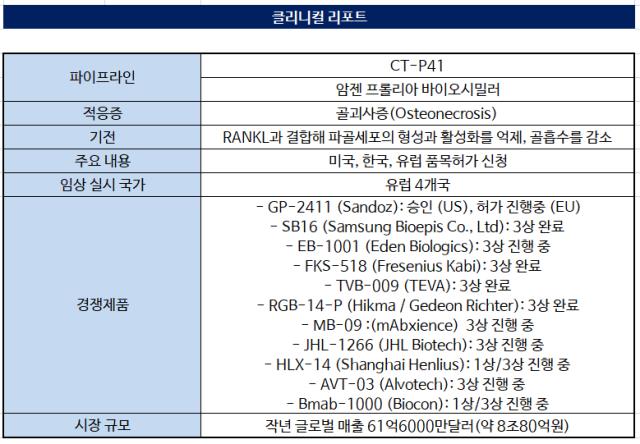
저널에 따르면 글로벌 임상 3상에 대해 78주간 평가한 결과 CT-P41과 오리지널 의약품 투여군 간의 1차 유효성 및 약력학 평가지표가 모두 동등성 기준에 부합했다. 오리지널 의약품 투여 후 52주차에 CT-P41을 투여받은 환자군에서도 유효성과 안전성이 확인됐다.
세부적으로 CT-P41 투여군과 오리지널 의약품 투여군으로 각각 나눠 베이스라인 대비 52주 차까지의 요추 골밀도 변화량을 1차 평가지표로 측정했는데 두 그룹 간 차이가 사전에 정의한 동등성 기준에 부합했다. 약력학적 1차 평가 변수인 골대사 주요 지표 골 흡수 표지자(s-CTX)의 첫 6개월 간 효과 곡선하 면적 평가에서도 동등성을 입증했다.
셀트리온은 임상 3상 결과를 기반으로 CT-P41의 주요 국가 승인 절차를 밟고 있다. 미국 식품의약국(FDA), 국내 식품의약품안전처, 유럽의약품청(EMA)에 품목허가 신청을 마치고 결과를 기다리는 중이다.
◇연매출 8조 큰 시장에도 '치열 경쟁·특허방어 전략' 과제
셀트리온이 프롤리아 바이오시밀러 개발에 뛰어든 이유는 높은 시장성 때문이다. 프롤리아는 골다공증 시장에서 압도적인 지위를 지녔다. 작년 기준 글로벌 매출이 61억6000만달러(약 8조80억원)에 달하는 블록버스터 의약품이다.
특히 골다공증 치료제 시장은 급속도로 커지는 추세다. 급격한 고령화로 환자가 늘고 있는 데다 골다공증 치료에 대한 인식도 높아지며 빠른 진단과 치료가 자리잡고 있다. 미국, 일본, 유럽 등 세계 골다공증 치료제 시장은 2033년까지 연간 평균 5.4%씩 성장해 179억달러(약 24조원)로 커질 것으로 관측된다.
셀트리온의 바이오시밀러 포트폴리오 확장 측면에서도 상당한 의미를 갖는다. 자가면역질환 치료제와 항암제 중심이었던 기존 포트폴리오를 골근격계 질환, 안과질환, 알레르기 질환 등으로 넓히고 있다. CT-P41이 품목허가를 획득하면 셀트리온의 첫 골 질환 바이오시밀러 제품이 될 전망이다.
큰 기대를 모으지만 넘어야 할 관문도 많다. 먼저 경쟁도 나날이 치열해지고 있다. 국내 삼성바이오에피스, 휴온스랩부터 산도스, 프레지니우스카비, 오가논, 테바, 바이오콘 글로벌 업체까지 프롤리아 바이오시밀러 시장에 도전장을 내밀었다. 산도스는 이미 올 3월 '쥬본티'의 FDA 품목허가를 획득, 첫 프롤리아 바이오시밀러에 이름을 올렸다. 바이오시밀러 경쟁에선 선점이 중요한 데 따라 시장 진입 속도를 앞당겨야 한다.
원개발사의 특허 장벽이 높아지고 있다는 점은 더욱 고려할 만한 요소다. 암젠은 특허 소송에 나서는 건 물론 특허 회피 전략에도 나서면서 오리지널 제품 지키기에 사활을 건 분위기다. 작년 5월 산도스를 상대로 특허 침해 소송을 건 데 이어 올 5월 셀트리온에도 CT-P41 특허 침해 소를 제기했다.
암젠은 순차치료 전략으로 골다공증 시장에서 입지를 공고히 하는 전략도 펼치고 있다. 프롤리아 후속으로 개발한 '이베니티'를 먼저 쓰고 이후 프롤리아를 처방해 시너지를 높이는 방식이다. 결국 바이오시밀러 개발사가 얼마나 빠르게 시장에 진입하고 오리지널 제품 대비 어떻게 우위에 설지가 관건이 될 것이라는 분석이다.
셀트리온 관계자는 "이번 발표를 통해 오리지널 의약품 대비 CT-P41의 유효성과 안전성을 재확인했다"면서 "글로벌 주요 국가에 진행 중인 허가 절차에 차질이 없도록 최선을 다할 방침"이라고 했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
best clicks
최신뉴스 in 전체기사
-
- [제닉스 road to IPO]거래소 지적받았던 FI 수익률 보장 '고심 끝 해지'
- [i-point]케이엔알시스템, HD현대중공업·KAI와 국책과제
- '바이오 명가' 솔리더스인베, AUM 5000억 정조준
- [thebell note] VC의 '임팩트투자' 거리두기
- '한발에 35억' 이노스페이스, 상업발사 9부 능선 넘었다
- [i-point]이노시스, 첨단 척추 치료기기 '엘디스큐' 인니에 전파
- '중국 잡아라' 삼성, '갤럭시Z폴드6 슬림' 출시 임박
- [IFA 2024]'동반성장 진심' KT, 행사 지원도 '차별화'
- [IFA 2024]조주완 LG전자 사장 "롤모델 소니, 인도 내셔널브랜드 구상"
- [네카오 페이사업 돋보기]동일한 종합 플랫폼 도약 목표, 금융사업은 '노선 차이'
차지현 기자의 다른 기사 보기
-
- [암 유도 미사일, 'RPT' 시장의 개화]국내선 가장 빨랐던 퓨쳐켐, 한발 늦은 넥스트 플로빅토 입지
- 신약개발 선언 셀트리온, 캐시카우 사업 다시 'CDMO' 겨냥
- 에스티팜, 신약 체질전환 승부수 'STP1002' 안전성 입증
- [암 유도 미사일, 'RPT' 시장의 개화]'플루빅토'가 연 시장, 잇단 빅파마 조단위 빅딜로 본 가능성
- [미지의 시장 '치매' 개화 길목에 서다]뉴로핏의 레켐비·키썬라 활용법, 'AI'로 관리·치료 밸류체인
- [토모큐브 IPO In-depth]세계 최초 타이틀에도 '보수적' 밸류, 매출 현실화에 방점
- 디앤디파마텍, 'NLY01' 불씨 살린다…새 적응증 2상 추진
- [토모큐브 IPO In-depth]100% 신주 모집에 담긴 자신감, 기존주주의 성장성 믿음
- [미지의 시장 '치매' 개화 길목에 서다]바이오오케스트라 메가딜 파워, BBB 투과율 높인 BDDS
- 최윤정 데뷔전, SK바이오팜의 넥스트 세노바메이트 'RPT'




















