에스바이오메딕스, PD '톱 데이터' 재확인 미국 3상 직행 세계 최대 학회서 1년 추적 결과 공개, 경쟁사 대비 우위 입증
이기욱 기자공개 2025-04-09 08:37:18
이 기사는 2025년 04월 08일 15시08분 thebell에 표출된 기사입니다
에스바이오메딕스의 핵심 파이프라인 파킨슨병(PD병) 치료제 'TED-A9'이 우수한 수준의 임상 데이터를 재확인했다. 세계 최대 알츠하이며·파킨슨병 학회에서 임상 1상의 최신 데이터를 공개하며 글로벌 경쟁 약물 대비 확실한 유효성을 알렸다.이번 데이터는 에스바이오메딕스가 올해 새롭게 수립한 개발 전략과 직결됐다는 점에서 의미가 있다. 경쟁사 블루락 테라퓨틱스(Bluerock Therapeutics)의 전략에 맞춰 미국 임상 3상 직행을 추진하기로 한 에스바이오메딕스 임상 계획에 보다 힘이 실릴 것으로 기대된다.
◇안전성·유효성 모두 입증, 저용량그룹도 경쟁약물 상회
에스바이오메딕스는 이달 1일부터 5일까지 오스트리아 빈에서 열린 세계 최대 규모의 알츠하이머병 및 파킨슨병 학회 'AD/PD 2025 Alzheimer's & Parkinson's Diseases Conference'에서 TED-A9의 임상시험 1년 추적 관찰 결과를 공개했다.
TED-A9은 PD병 치료제로 에스바이오메딕스의 핵심 파이프라인으로 평가된다. 에스바이오메득스의 자체 기술 'TED'를 통해 분화한 '중뇌 복측 도파민 신경전구세포(NPC)'를 활용한 세포 치료제다. 환자 뇌 안의 '조가비핵(putamen)'에 주사로 직접 투여하는 방식으로 기존 약물들과 차이점을 지닌다.
2023년 1/2a상에 첫 진입한 이후 작년 2월 환자 투여가 완료됐다. 단계적으로 총 12명에게 투여가 이뤄졌다. 2023년 5월 315만개 세포 저용량 치료제를 3명에게 투여했고 같은 해 9월 630만개 세포 고용량 치료제도 3명에게 투여했다. 작년 2월 저용량 3명과 고용량 3명 투여가 추가로 진행됐다.
이번에 발표된 데이터는 작년 2월 투여가 완료된 6명의 1년 추적 데이터를 포함한 임상 1/2a상 1년 추적 데이터다. 에스바이오메딕스는 이미 작년 2023년 투여 환자 6명에 대한 1년 추적 데이터를 중간 공개하며 글로벌 최고 수준의 데이터를 확인한 바 있다.
이번 학회에서도 글로벌 톱 데이터 위상이 재확인됐다. TED-A9의 실질적인 경쟁 약물로는 블루락 테라퓨틱스의 'BRT-DA01'이 있다. 블루락 테라퓨틱스는 독일 바이엘의 자회사로 BRT-DA01 역시 TED-A9과 유사한 배아줄기세포 유래 세포치료제다.
우선 TED-A9은 안전성 측면에서 세포 이식에 따른 사망 사례는 단 한 건도 발견되지 않았다. 이식 후 MRI 영상을 통해 종양형성 및 세포의 과증식도 없음이 확인됐고 이식된 세포에 의해 발생하는 이상운동증(graft-induced dyskinesia)도 나타나지 않았다.
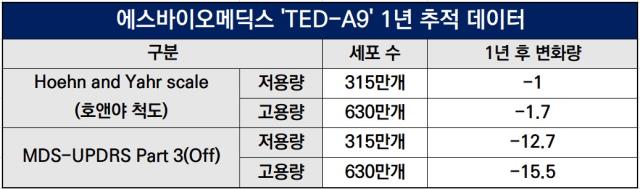
대표적인 운동기능 평가인 호엔야 척도(Hoehn & Yahr Scale)에서도 저용량 그룹은 이식 전에 비해 평균 27.8% 호전 된 것으로 나타났다. 평균 3.7단계에서 1단계씩 감소했다. 고용량 그룹은 평균 3.8단계에서 1.7단계씩 낮아지며 43.1% 호전됐다.
또 다른 운동기능 개선 평가 척도인 'MDS-UPDRS Part 3(Off)' 평가에서도 저용량 그룹은 이식 전에 비해 평균 12.7점 감소하며 21.8% 호전된 결과를 보였다. 고용량 그룹은 평균 15.5점 낮아지면 26.9% 호전됐다.
12개월 후 12.4점이 개선된 블루락 티라퓨틱스의 BRT-DA01 대비 저용량 그룹은 0.3점, 고용량그룹은 3.1점 우수한 수치를 보였다.
◇블루락 상회 데이터 필수, 수정 계획 힘 실릴 듯
이번 데이터 발표는 에스바이오메딕스의 새로운 임상 전략과 직결돼 있다는 점에서 보다 의미가 깊다. 에스바이오메딕스는 올해 초 TED-A9의 개발 계획을 전면 수정했다. 블루락 테라퓨틱스가 BRT-DA01의 임상 계획을 바꾸자 발 빠르게 맞춤형 대응 전략을 짰다.
블루락 테라퓨틱스는 1월 미국 샌프란시스코에서 열린 'JP모간 헬스케어 컨퍼런스'에서 올해 BRT-DA01 미국 임상 3상을 추진하겠다는 뜻을 밝혔다. 현재 미국 임상 1상만을 완료한 상태지만 2상을 건너뛰고 곧장 임상 3상에 도전할 계획이다.
재생의학첨단치료(RMAT) 지정에 따라 미국 FDA와 1상 시험 데이터 관련 논의를 거친 후 진행됐다. 올해 상반기 중 102명으로 대상으로 하는 3상 시험이 시작될 예정이다.
에스바이오메딕스 역시 올해 2b상을 건너뛰고 미국 3상에 곧장 도전할 예정이다. 동일한 작용기전을 갖고 있는 만큼 블루락 테라퓨틱스와 같은 트랙으로 미국 식품의약국(FDA)을 설득할 계획이다.
이를 위해 필수적인 것은 블루락 테라퓨틱스를 상회하는 데이터였다. 작년 공개된 중간 데이터 이상의 최신 데이터가 확보됐기 때문에 에스바이오메딕스의 새로운 임상 전략에도 더욱 힘이 실리게 됐다.
에스바이오메딕스는 현재 신약개발 및 라이선싱 전문 컨설팅기업 GID파트너스와 손을 잡고 미국 3상 임상을 추진 중이다. 이르면 연내 FDA에 IND를 신청할 계획이며 내년부터 FDA 실사 등 본격적인 심사 작업이 시작될 것으로 예상된다. 심사에 대비한 공장 신축 등도 진행 중이다.
에스바이오메딕스 관계자는 "근본적인 치료제가 없는 파킨슨병에서 세계 최고 데이터가 확보됐다"며 "실질적 경쟁사인 블루락 테라퓨틱스를 압도하는 수치"라고 평가했다.
< 저작권자 ⓒ 자본시장 미디어 'thebell', 무단 전재, 재배포 및 AI학습 이용 금지 >
관련기사
- 에스바이오메딕스, '숨은 진주' 미용의료 자회사 '에스테팜'
- 에스바이오메딕스 "파킨슨 치료제 글로벌 상업화 원년"
- "성공적 임상인데…" 에스바이오, 엇갈린 파킨슨 임상 해석
- 에스바이오, 주력 '하지허혈 본임상' 이젠 해외 L/O 승부수
- 에스엘에스바이오, ‘납입능력 확인의무’ 첫사례될까
- 이달 환기종목 해제 결론, 선제적 자본확충으로 '이상무'
- 이유있는 '미국 3상' 직행, 경쟁사 전략 맞춘 빠른 대응
- 첨생법 한계 타파할 '규제샌드박스', 상업화 빨라진다
- 본질가치는 데이터, '파킨슨' 경쟁사 대비 우위 결과 확보
- '파킨슨' 타깃 세포공학 플랫폼, 첨생법 흐름을 타다
best clicks
최신뉴스 in 인더스트리
-
- 거래소, 3시간 심사 끝에 제노스코 상장 '미승인' 확정
- 대방건설, '부채비율 80%' 안정적 재무구조 유지
- [i-point]신테카바이오 "동물실험 단계적 폐지 수혜 기대"
- [변곡점 맞은 해운업]'퀀텀점프' 현대LNG해운, 선대 확장효과 '톡톡'
- [중간지주 배당수익 분석]HD한국조선해양 수익원천 자회사 '금융→조선' 이동
- [상호관세 후폭풍]트럼프의 '90일 유예·애플 지목', 삼성전자 득실은
- '반년 장고' 거래소, 제노스코 상장심위 개최 '미승인' 가닥
- [시큐리티 컴퍼니 리포트]수산아이앤티, 무차입 경영 비결 '16년 흑자'
- [i-point]비트맥스, 비트코인 37개 추가 매입
- [i-point]엔켐 "ESS용 전해액 공급 확대 기대"
이기욱 기자의 다른 기사 보기
-
- [제약사 IPO 전략 점검]아이디언스, 일동제약 '신약 가치' 지킬 최후의 보루
- 지오영 '토탈 헬스케어' 속도, IT솔루션 신사업 추진
- [thebell interview]엠비디 "기술수출 기반 해외 활로 확장, IPO 계획 이상무"
- 퓨쳐켐 'ORR 60%' 숨은 의미, 규제기관·경쟁사와 다른 기준
- 에스바이오메딕스, PD '톱 데이터' 재확인 미국 3상 직행
- 'AUM 20조' 아치벤처파트너스, 'K-뷰티 의료기기' 주목
- 엠비디, 키야텍에 암 분석 플랫폼 L/O…'매출기반' 구축
- [제약사 개발비 자산화 점검]'개량신약' 중심 종근당, 녹내장약 '중단' 고혈압약 집중
- 에이비온의 '현금 마련' 전략, 자산처분에 투자유치까지
- [제약사 IPO 전략 점검]제일약품 체질 개선 이끈 온코닉, 확고해진 3세 승계 기반























